Diskussion
Das reticulopodiale Netzwerk von Reticulomyxa filosa mit seinen sich schnell aus- und rückbildenden, sehr formveränderlichen Pseudopodien dient dem Nahrungserwerb und der Fortbewegung. Um große Substratflächen besiedeln und "abweiden" zu können, hat sich das Cytoskelett dieses Organismus in vielfältiger Hinsicht an die speziellen Lebensbedingungen angepaßt.
Ähnlich wie bei Nervenzellen (Joshi & Baas, 1993) sind der Zellkörper mit der Erbinformation und der Proteinsynthese weit von den Ausläufern der Zelle entfernt und mit diesen nur durch fadenförmige Ausläufer verbunden, was Anpassungen hinsichtlich der Geschwindigkeit des intrazellulären Transports und der Spezifität der dafür zuständigen Motorproteine (Schliwa et al., 1991) erforderlich macht. Anders als bei Axonen hingegen sind bei der Ausbildung der Zellausläufer weniger die Präzision der Zielfindung und die Beständigkeit einmal ausgebildeter Verbindungen wichtig, als vielmehr Schnelligkeit der Aus- und Rückbildung von Pseudopodien und der sie stützenden Mikrotubuli. Das RPN muß in der Lage sein, schnell auf chemische und physikalische Stimuli wie ein lokales Nahrungsangebot oder ungünstige Lebensbedingungen zu reagieren. Zudem ist das reticulopodiale Netzwerk durch die Fähigkeit zur Refusion mit abgetrennten Pseudopodien und der Verschmelzung mit fremden Plasmodien oder "Adoption" abgetrennter Pseudopodien gegen Beschädigung geschützt. Mithin ist also die Reorganisation des gesamten Cytoskeletts eine wesentliche Konsequenz der Lebensweise.
Welche Auswirkungen diese speziellen Anforderungen auf die Organisation des Cytoskeletts von Reticulomyxa gehabt haben, illustriert mithin nicht nur die Anpassung an die Lebensumstände, sondern ermöglicht wiederum auch Rückschlüsse auf die Anpassungs- und Wandlungsfähigkeit anderer Cytoskelett-abhängiger Lebensformen und -vorgänge.
MTOCs und die Polarität von Mikrotubuli
Das lichtmikroskopische Bild des RPN von Reticulomyxa läßt dieses als stark asymmetrisch und nur wenig geordnet erscheinen. Durch die ständige Ausbildung von neuen Verzweigungen und deren Fusion mit anderen Seitensträngen mit manchmal sogar gegenläufiger Ausrichtung scheint ein geordneter Aufbau des Cytoskeletts, wie bei anderen Organismen die Regel, zumindest schwierig zu sein.
Beschaffenheit und Lage von MTOCs
Bei den meisten Zellen entstehen MT nicht frei an beliebiger Stelle im Plasma, sondern werden von wenigen, zumeist zentralen Mikrotubuli-organisierenden Zentren (MTOCs) gebildet und bleiben für die Dauer ihres Bestehens auch mit ihnen verbunden. Bei tierischen Zellen sind die bekanntesten MTOCs Centrosomen oder Basalkörper, gelegentlich auch die Kernmembran; bei pflanzlichen Zellen sind zumindest die Centrosomen während der Mitose durch die Polkappen ersetzt, und es gibt wandständige MTOCs, die corticale MT bilden (McDonald et al., 1993).
Eine Sonderform bilden hierbei die Axone der Nervenzellen. Die MT in den Axonen werden zwar von den im Zellkörper gelegenen Centrosomen gebildet (Ahmad et al., 1994), trennen sich dann aber von diesen und existieren weiterhin ohne direkten Kontakt zur Centrosomenregion. Obwohl diese MT nicht mehr mit einem MTOC in Verbindung stehen, sind sie aber noch in der Lage, durch Längenwachstum erhebliche Mengen freien Tubulins zu binden (Miller & Joshi, 1996; Joshi & Baas, 1993).
Bei den Zellen von Reticulomyxa wurden bislang keine auffälligen MTOCs entdeckt (Euteneuer et al., 1989). Trotz der gewaltigen Größe des Zellkörpers kann jedoch davon ausgegangen werden, daß zumindest das Vorhandensein von auffällig strukturierten Centrosomen den zahlreichen Beobachtern nicht entgangen wäre. Das Fehlen solcher Centrosome sagt jedoch noch nichts über das Vorhandensein anderer einfacher organisierter MTOCs aus. Während man früher noch davon ausging, daß die Centriole selbst strukturelle Vorlage für neu zu bildende MTs seien, beobachteten Evans et al. (1985), daß die MT nie in direkten Kontakt mit den Centriolen stehen, sondern daß die Bildung von MT vom pericentriolären Material initiiert wird. MTOCs müssen also nicht zwangsläufig auffällige und zentral lokalisierte Strukturen sein.
Die Komponenten des pericentriolären Materials sind noch weitgehend unbekannt (Doxsey et al., 1994). Bisher wurden mittels monoklonaler Antikörper zwar eine ganze Reihe von Proteinen nachgewiesen, deren Funktion jedoch zumeist nicht aufgeklärt ist (Kuriyama, 1992). So erkennt der Antikörper CTR 210 (Bailley et al., 1988), der ursprünglich gegen menschliche Centrosome gerichtet ist, bei verschiedenen Organismen Bestandteile von MTOCs. Bei Paramecium (Keryer et al., 1990) werden zwei Peptide von 72 und 80 kD in den Basalkörpern markiert, während Moudjou et al. (1996) in Lymphoblasten mit diesem Antikörper ein 67 kD Protein in der Centrosomen-Fraktion markieren konnten. In der vorliegenden Arbeit konnte gezeigt werden, daß bei Reticulomyxa dieser Antikörper kleine, lichtmikroskopisch nicht weiter identifizierbare Strukturen markiert (Abb. 16 und 17).
Ein Antikörper, der spezifisch gegen Reticulomyxa g-Tubulin gerichtet ist, zeigt neben einer diffusen Hintergrundmarkierung eine ähnliche Antigen-Verteilung (Abb. 18), (Kube-Granderath & Schliwa, 1996).
Dem g-Tubulin, einem weiteren Mitglied der Tubulin-Superfamilie, kommt eine wesentliche Bedeutung bei der Bildung von MT zu. g-Tubulin konnte als wesentlicher funktionaler Bestandteil aller bisher untersuchten MTOCs identifiziert werden (Joshi et al., 1992; Wolf & Joshi, 1996; Joshi, 1993; McDonald et al., 1993; Gueth-Hallonet et al., 1993), unabhängig davon, ob diese Centriole enthalten oder acentriolär sind. Im Gegensatz zu dem Antigen des mAK CTR 210 kommt g-Tubulin jedoch nicht nur in MTOCs vor. Moudjou et al. (1996) fanden in verschiedenen Zellinien, daß die Hauptmasse des g-Tubulins in gelöster Form im Cytosol vorliegt. Dabei handelt es sich zumeist um hochmolekulare (wahrscheinlich nicht-Chaperon-) Komplexe unbekannter Natur. Das Vorkommen von cytosolisch gelöstem g-Tubulin könnte auch die Ursache dafür sein, daß die Markierung mit dem pAK gegen Reticulomyxa-g-Tubulin auch eine diffuse Hintergrundmarkierung ergibt.
In MTOCs scheint g-Tubulin, wie Moritz et al. (1995) und Zheng et al. (1995) zeigten, in 25-30 nm dicken und ca. 10 nm hohen ringförmigen Komplexen, den gTuRCs (g-tubulin ring complex) organisiert zu sein. Diese gTuRCs werden heute als die kleinsten funktionellen Untereinheiten der MT-Bildung betrachtet (Zheng et al., 1995).
Tatsächlich finden sich an den distalen Enden von MT häufiger kleine kragenförmige Strukturen (Abb. 14, 55 und 56), die den von Golz & Hauser (1991) bei Allogromia gefundenen und als einfache MTOCs angesprochenen Organellen gleichen. Diese kragenförmigen Strukturen haben eine Größe von 60x25nm, sind also ausreichend groß, um mindestens einen gTuRC zu enthalten.
Die Vermutung liegt nahe, daß auch die proximalen MT-Enden mit ähnlichen kragenförmigen MTOC-Strukturen versehen sind. Zumindest findet man gelegentlich (Abb. 15) in Schnitten MT, die von benachbarten MTOCs aus in gegensätzliche Richtungen laufen. Die elektronenmikroskopischen Beobachtungen legen also den Schluß nahe, daß beide Enden der MT von identisch aussehenden MTOCs bedeckt sind.
Im Rahmen dieser Arbeiten konnte nicht bewiesen werden, daß die in der IIF markierten, g-Tubulin und die das CTR 210-Antigen enthaltenden Strukturen identisch mit diesen unauffälligen MT-Kappen sind. Das kann nur angenommen werden, weil Größe und Verteilung einander in etwa entsprechen. Eine endgültige Zuordnung der Antigene zu distinkten intrazellulären Strukturen kann letztlich nur durch die elektronenmikroskopische Immunogold-Markierung erfolgen.
Möglich wäre aber auch, daß die Bildung von MT ähnlich wie bei den axonemalen MT von Nervenzellen vor sich geht (Yu et al., 1993), wo die MT nach der Bildung von dem MTOC getrennt und in diesem Zustand in die Axone transportiert werden. Da der Transport von MTs durch aktives Aneinandergleiten in Reticulomyxa nachgewiesen und zum Gegenstand von diversen Untersuchungen gemacht wurde (Chen & Schliwa, 1990; Koonce et al., 1987), kann davon ausgegangen werden, daß die MTOCs entweder mit diesen mittransportiert werden, oder aber die gebildeten MTs bald von im Zellkörper lokalisierten MTOCs entlassen.
Experimente, um mittels heterologer Polymerisation von Fremdtubulin nach der Methode von Simon & Salmon (1990) MT-nucleierende Zentren lokalisieren zu können (Abb. 21 bis 24) erbrachten kein eindeutiges Ergebnis. Es wurden zwar bei hohen Tubulin-Konzentrationen (bis 1 mg/ml) auch innerhalb des Zellkörpers von Reticulomyxa zusätzlich gebildete neue MT nachgewiesen, die sich aber nicht strahlenförmig um ein potentielles MTOC anordneten, wie z.B. in den Arbeiten von Evans et al. (1985) oder Mitchison & Kirschner (1984). Die plausibelste Erklärung für dieses Phänomen wäre, daß die MTOCs von Reticulomyxa - wie nach dem elektronenmikroskopischen Bild der putativen MTOCs auch zu vermuten wäre - nur die Kapazität besitzen, jeweils einen einzigen Mikrotubulus zu bilden. Daher können zwar neue MTs gebildet werden, diese strahlen aber nicht asterförmig von einem distinkten Ursprung aus.
Wurde die Tubulinkonzentration soweit gesenkt, daß keine freie Polymerisation mehr stattfinden konnte, fanden sich auch in den Zellen von Reticulomyxa keine neugebildeten MT mehr. Die kritische Tubulinkonzentration für die Verlängerung bestehender MT oder die Neubildung von MTs an den MTOCs von Reticulomyxa liegt also relativ hoch.
Polarität der MT
Vor dem Hintergrund, daß mikroskopisch erkennbare MTOCs in Reticulomyxa fehlten und daß Reticulomyxa nur ein Motorprotein besitzt, das sowohl für antero- als auch für retrograden Transport zuständig ist (Schliwa et al., 1991), stellt sich die Frage, ob die MT von Reticulomyxa überhaupt eine einheitliche Polarität wie in anderen Organismen aufweisen.
Verschiedene Autoren haben versucht, auf diese Frage eine schlüssige Antwort zu geben. Euteneuer et al. (1989) haben schließlich mittels der Dynein-Dekorationstechnik nach Haimo (1982), bei der isoliertes flagellares Dynein an die bestehenden MT gebunden wird, nachgewiesen, daß die MT von Reticulomyxa offenbar doch einheitlich und konventionell, mit dem plus-Ende zur Zellperipherie, angeordnet sind. Gleichzeitig erklärten sie, daß die gängige Polaritätsbestimmung mit Hilfe der "Hook-Dekoration" bei Reticulomyxa undurchführbar sei.
In der vorliegenden Arbeit konnte jedoch gezeigt werde, daß die "Hook-Dekoration" durch anpolymerisiertes Hirntubulin mit geringfügigen Modifikationen der Methode von Heidemann (1991) jedoch durchführbar ist. Entscheidend für das Gelingen der "Hook-Dekoration" war die von der Tubulin-Inkubation getrennte Lysis, der Einsatz von EGTA als Chelator für zweiwertige Ionen als Ersatz für EDTA, und daß das verwendete Lysismedium VIII (Schliwa et al., 1991) wegen des Vanadatzusatzes die Dynein-Querbrücken zwischen den MT im Rigor-Zustand stabilisiert und damit den in situ-Bestand der MT-Bündel gewährleistet.
An den so vor Auflösung geschützten MT-Bündeln bildeten sich unter günstigen Bedingungen zahlreiche "Hooks". Die Bildung dieser Haken geht, wie z.B. in Abb. 7 zu erkennen, von einzelnen Tubulin-Protofilamenten aus, die sich parallel zu MT anordnen. Mit der Anlagerung weiterer Protofilamente vor (Abb. 8. 8) oder nach der Bindung an einen Mikrotubulus setzt die Bildung eines deutlich erkennbaren C-Tubulus oder Hakens ein.
Trotz der allgemein guten Erhaltung der MT von Reticulomyxa war die Anzahl der dekorierten MT mit 23% (von denen nur rund 1/5 wie im Methodenteil erklärt eindeutig interpretierbar war) eher gering. Ob sich hierin eine Eigenart der Tubuline des untersuchten Organismus ausdrückt oder ob die starke Dekoration der MT mit MAPs die Bindung weiterer Tubulin-Protofilamentblättchen verhindert hat, kann nicht eindeutig beantwortet werden. Es wurde versucht, alle wesentlichen Parameter der "Hook-Dekoration" zu verändern: Tubulinkonzentration, Inkubationsdauer und -temperatur sowie EGTA- und DMSO-Konzentration konnten variiert werden ohne die Ausbeute wesentlich zu erhöhen.
Interessant war der Einfluß der EGTA-Konzentration auf die Hook-Bildung, denn bei EGTA-Konzentration über 4 mM (Abb. 4 und 5) bilden sich große Tubulinaggregate mit unbestimmbarer Polarität. Ähnliche Aggregate entstehen z. B., wenn die Polymerisation von Tubulin in Puffern zusammen mit Harnstoff oder Guanidinhydrochlorid durchgeführt wird. Durch Wasserstoffbrücken zwischen Agens und Tubulin sowie durch die Überdeckung der starken Oberflächenladung der Tubulinmoleküle werden wahrscheinlich verschiedene Molekülzustände und Polymerisationsformen induziert (Wolff et al., 1996).
Von den interpretierbaren Hooks bei normalen EGTA-Konzentrationen (1mM) wiesen über 70% auf MT mit einer konventionellen Orientierung mit dem plus-Ende zur Zellperipherie hin. Dies ist ein weitaus geringerer Prozentsatz, als der von Euteneuer et al. (1989) bei der Dynein-Dekoration erzielte.
Wie schon Heidemann & McIntosh (1980) nachwiesen, ist die Methode der "Hook-Dekoration" mit einer gewissen Fehlerrate behaftet, denn sie beobachteten, daß nur zwischen 80 und 90% der Hooks die Polarität der MT korrekt anzeigen. Wenn bei Reticulomyxa also nur 70% der dekorierten MT gleichgerichtete Hooks aufweisen, kann dies entweder als ein Anzeichen für die besonderen Schwierigkeiten der Tubulin-Dekoration bei diesem Objekt gewertet werden, oder es existiert tatsächlich eine Subpopulation von MT mit umgekehrter Orientierung, die mit ihrem minus-Ende in die Zellperipherie weisen.
Bei der hohen Umbaurate der cytoplasmatischen MT und der ständigen Umgestaltung des RPN wäre ein geringer Prozentsatz andersorientierter MT auch nicht verwunderlich, wenn man nicht sogar einen regelrechten Transport solcher MT annehmen will. Dieses Phänomen wurde von Mikhailov & Gundersen (1995) bei Untersuchungen an Fibroblastenzellen dokumentiert, wo ein zentripetaler Transport von MT zum Zellkern hin stattfindet und möglicherweise eine physiologische Funktion beim Transport von Pinocytosevesikeln erfüllt.
Gegen das Vorkommen einer konstant großen Subpopulation andersorientierter MT sprechen allerdings die Ergebnisse von Euteneuer et al. (1989), die bei über 90% der MT eine identische Orientierung gefunden haben. Daher ist eine mögliche Erklärung der 30%unkonventionell orientierten MT, die in der "Hook-Dekoration" gefunden wurden, daß diese Methode entweder durch biochemische Besonderheiten des Reticulomyxa-Tubulins oder durch den starken Besatz der MT mit MAPs kein zuverlässiges Ergebnis lieferte.
Auch wenn es einige unkonventionell orientierte MT gäbe, hätten diese wahrscheinlich keinen großen Einfluß auf die Transportraten für den antero- und retrograden Transport, die bei Reticulomyxa typischerweise gleich groß sind (Euteneuer et al., 1989). Mithin unterstützen die Ergebnisse der "Hook-Dekoration" die These, daß Reticulomyxa ein Motorprotein besitzt, das selbst zu bidirektionalem Transport in der Lage ist, und daß die Bidirektionalität des Transports nicht durch die wahllose Polaritätsverteilung von MT zustande kommt.
Die Wirkung von 6-DMAP
6-DMAP ist schon lange als Inhibitor der Zellteilung bekannt (Rebhun et al., 1973). Die Autoren fanden, daß 300 µM des Puromycin-Analogons 6-DMAP die Eifurchung verschiedener Organismen inhibiert. Im Gegensatz zu anderen Drogen war die Zeit bis zum Eintritt der Wirkung bei 6-DMAP relativ kurz (5 Minuten), und die Wirkung war reversibel. 6-DMAP fördert die Aufnahme von Aminosäuren und ist selber auch leicht metabolisierbar, so daß sich die Zellen von der Behandlung erholen konnten. Die Wirkung auf den Zellzyklus entfaltet 6-DMAP wohl aufgrund seiner inhibitorischen Wirkung auf einen Teil der Proteinkinasen. Die ProteinkinaseC wird von 6-DMAP nicht inhibiert (Nishizuka, 1984), aber möglicherweise erfolgt der Einfluß auf den Teilungszyklus der Zelle über die Inhibition der Cyclin-Degradation, die von Luca und Ruderman (1989) in in-vitro Experimenten nachgewiesen wurde.
Im Gegensatz zu der eingangs beobachteten inhibitorischen Wirkung von 6-DMAP auf die Zellteilung gelang es Moses et al. (1995), mit 6-DMAP alleine oder zusammen mit dem Calcium-Ionophor A 23187 den durch Colcemid-Behandlung hervorgerufenen Arrest von Mausoocyten in der Metaphase II aufzuheben. Neuere Untersuchungen von Neant & Dube (1996) legen nahe, daß die Hemmung der Protein-Phosphorylierung durch 6-DMAP bei meiotischen Zellen zur Aufhebung des Metaphasearrestes und zum Übergang in einen Interphase-ähnlichen Zustand mit dauerhafter DNA-Synthese führt, während mitotische Zellen unter 6-DMAP-Einfluß ihre DNA normal replizieren können, dann aber in der Metaphase arretiert werden.
Die Wirkung von 6-DMAP auf die Zellen von Reticulomyxa ist äußerst ungewöhnlich. In einer Vielzahl von Versuchen bestätigte sich, daß die Zellkörper nach längerer Inkubation mit einer allmählichen Reduktion des RPN reagieren und dann absterben. Werden vor dem Absterben des Zellkörpers jedoch Abschnitte des RPN abgetrennt, so können sie den zugehörigen Zellkörper noch um einige Stunden augenscheinlich unbeeinträchtigt überleben.
Dazu ist anzumerken, daß eine 16-bis 24stündige Inkubation in 6-DMAP außergewöhnlich lang ist. Im allgemeinen wird 6-DMAP nur für wenige Stunden (Neant & Dube, 1996; Moses et al., 1995), bis maximal über Nacht (Kaczanowska et al., 1996) eingesetzt. Während der bei anderen Organismen üblichen Inkubationsdauern tritt also bei Reticulomyxa bis auf den allmählichen Rückbau des MT-Cytoskeletts kein Effekt auf.
Diese Rückbildung scheint nicht mit einem bestimmten Zeitpunkt des Zellzyklus gekoppelt zu sein. Die Anzahl der MT nimmt vielmehr allmählich ab, was nahelegt, daß entweder die beobachteten kragenförmigen MTOCs im Verlauf der Inkubation funktionsunfähig werden, oder das Tubulin selber seine Polymerisationsfähigkeit verliert. Zum Zeitpunkt des Zelltodes sind aber immer noch einige MT vorhanden.
Einen geringfügigen Einfluß auf das MT-Cytoskelett konnten auch Kaczanowska et al. (1996) an Paramecium nachweisen, die eine Hypophosphorylierung der Basalkörper sowie ein Fehlen der CTR 210-Antigene als Folge von 6-DMAP-Behandlungen beobachteten. Allerdings bemerken die Autoren an anderer Stelle auch, daß die so veränderten Basalkörper dennoch zur Nucleation von MT in der Lage sind.
Die langzeit-inkubierten Zellen von Reticulomyxa weisen eine ungewöhnliche Verteilung von ER und freien Ribosomen auf. Beide sind bei unbehandelten Zellen strikt auf den Zellkörper beschränkt, kommen in 6-DMAP-behandelten Zellen jedoch regelmäßig im gesamten RPN vor. Möglicherweise beruht die veränderte Verteilung auf einer Beeinträchtigung von Strukturen, die für die Zonierung des Plasmas verantwortlich sind.
Bislang ist ungeklärt, wodurch die Zonierung des Cytoplasmas in Reticulomyxa hervorgerufen wird. Zwei Möglichkeiten erscheinen denkbar: Entweder das MT-Cytoskelett führt durch den Transport von Zellorganellen zu ihrer Ungleichverteilung, oder am Übergang zwischen Zellkörper und RPN existiert eine bislang unbeobachtete Barriere, z.B. aus feinfilamentösen Proteinen, die passiv Zellorganellen zurückhält.
Eine Verbindung zwischen ER und MT wird bei Pilzen (Rupes et al., 1995), der Alge Acetabularia (Menzel, 1994) und in Axonen von Nervenzellen (Price et al., 1991) als sicher angenommen. Da sich die Anzahl der MT bei 6-DMAP-Behandlung jedoch verringert, kann dies nicht zu einem vermehrten Auswärtstransport von ER führen. Ein direkter Zusammenhang zwischen dem Abbau von MT und der Fehlverteilung von Ribosomen und ER könnte jedoch trotzdem bestehen, falls die MT zur Positionierung des ER dienen sollten und durch ihr Fehlen die allmähliche Verteilung des ERs nicht verhindern könnten.
Möglich wäre auch, daß die Interaktion bestimmter MAPs mit dem ER durch 6-DMAP beeinflußt wird. Kaczanowska et al. (1996) stellten fest, daß die 6-DMAP-Behandlung auch den Phosphorylierungsgrad schwerer Proteine von 250 und 178 kD reduziert, und vermuten, daß es sich dabei um MAPs handele.
Wie oben bereits aufgeführt, wäre es auch möglich, daß die Kompartimentierung des Plasmas in Reticulomyxa wie bei den daraufhin untersuchten Gewebekulturzellen durch ein feinfilamentöses Netzwerk erfolgt. Das Plasma von Gewebekulturzellen ist, wie in Permissionsversuchen mit mikroinjezierten Partikeln gezeigt wurde, in eine zentrale, eine distale und eine kernnahe Zone gegliedert (Provance et al., 1993). Partikel, die in den zentralen Plasmabereich injiziert werden, sind nicht in der Lage, das dichte Netzwerk dünner Filamente - die Autoren nehmen an, daß es sich dabei um Actin handele -, das die distale Zone erfüllt, zu durchdringen (Provance et al., 1993).
Ein solches Netzwerk ist bei Reticulomyxa zwar bislang nicht beobachtet worden, würde aber auch nur unter speziellen experimentellen Bedingungen (z.B. bei Präparaten aus kompletten Zellen im Hochspannungs-EM oder bei Permissionsversuchen mit mikroinjezierten Partikeln) sichtbar werden. Daher ist nicht auszuschließen, daß eine derartige physikalische Barriere in Reticulomyxa für die Kompartimentierung des Zellkörpers verantwortlich ist und möglicherweise durch 6-DMAP beeinträchtigt wird. Dafür spricht ebenfalls, daß auch Kaczanowska et al. (1996) in Paramecium eine Disorganisation filamentöser Netzwerke als Folge von 6-DMAP-Behandlungen beobachteten.
Möglich wäre, daß die Inhibition der Mitose durch 6-DMAP zum Zelltod geführt haben könnte. Das ist aber recht unwahrscheinlich, da weder mikroskopisch noch elektronenmikroskopisch bei 6-DMAP-behandelten Zellen Mitosestadien gefunden wurden, obwohl dieses Agens mitotische Zellen zumeist in der leicht kenntlichen Metaphase arretiert. Die beobachtete ungewöhnliche Bindung von Tubulin an die Kernmembran beruht wahrscheinlich auf der post-mortem Einlagerung von Tubulin (das auch in vivo zu einem beträchtlichen Prozentsatz als integrales Protein vorliegen kann (Laporte et al., 1993)).
Deshalb ist die wahrscheinlichste Ursache für das Absterben der Zellen in einer Stoffwechselstörung, entweder über Proteine, deren Phosphorylierung durch 6-DMAP verhindert wurde, oder über die Fehlverteilung des ER und der Ribosomen zu sehen.
Beeinflussung des MT-Polymerisationsverhaltens
Die Mikrotubuli einer Zelle unterliegen dem ständigen Auf- und Abbau, eine Eigenschaft, die auch als dynamische Instabilität bezeichnet wird. Die beiden Enden eines MT unterscheiden sich hinsichtlich der Wachstums- und Schrumpfungsgeschwindigkeit sowie der Wahrscheinlichkeit für Wachstum oder Schrumpfung. (Reviews in Cassimeris et al., 1994; Avila, 1990.)
Eine wichtige Rolle bei der Unterscheidung von schnellwachsendem plus- und langsamwachsenden minus-Ende spielt die Hydrolyse von gebundenem GTP (Erickson & O'Brien, 1992). Nicht hydrolysiertes GTP an den Enden des MT begünstigt sein Wachstum (Caplow & Shanks, 1996), während das durch Hydrolyse entstehende GDP an den Enden des MT seine Verkürzung begünstigt. Das Vorhandensein eines terminalen GTP-caps ist eine der Ursachen für das unterschiedliche Wachstums- und Schrumpfungsverhalten der beiden Mt-Enden (Martin et al., 1991). Kürzlich wurde auch ein Tubulin Dimere bindendes Protein gefunden (Spittle & Cassimeris, 1996), dem möglicherweise eine größere Rolle bei dem unterschiedlichen Wachstum der beiden MT-Ende zukommt.
Außer dem Vorhandensein einer GTP-Kappe gibt es noch eine ganze Reihe anderer Faktoren, welche die Stabilität von MT beeinflussen: Mg2+ fördert die Polymerisation von MT (Grover & Hamel, 1994), ebenso die meisten Mikrotubuli-Assoziierten Proteine (Pedrotti & Islam, 1995; Ferhat et al., 1996; Vasquez et al., 1994), insbesondere das STOP-MAP (stable tubule only polypeptide) (Margolis et al., 1990), das mit Ca2+-Calmodulin interagiert und die Stabilität von MT reguliert (Pirollet et al., 1992). Das Ca2+-Ion selbst hingegen fördert die Depolymerisation von MT (Weisenberg, 1973), ebenso wie Kälte (Bryan, 1974).
Zusätzlich zu diesen physiologischen Faktoren gibt es noch eine Reihe teilweise natürlicher und teils synthetischer Drogen, die auf die Stabilität von MT Einfluß haben. In dieser Arbeit wurde versucht, durch den Einsatz verschiedener MT-stabilisierender oder -destabilisierender Agenzien die Eigenschaften der Reticulomyxa-MT möglichst weitgehend zu charakterisieren.
Taxol
Taxol, ein aus der Eibe Taxus brevifolia isoliertes Diterpen (Wani et al., 1971), setzt in vitro die kritische Konzentration für die Polymerisation von Tubulin herab (Thompson et al., 1981) und schützt die MT vor depolymerisierenden Einflüssen (Schiff et al., 1979). Derry et al. (1995) fanden, daß schon geringe Taxolkonzentrationen < 1 µM zu einer Veränderung des dynamischen Verhaltens von MT Plus- und minus-Enden führten. Höhere Taxolkonzentrationen > 1 µM führen darüber hinaus zur Erhöhung der Polymerisationsrate.
Wegen dieser massiven Einflüsse auf die Dynamik des Cytoskeletts wird Taxol, ebenso wie Vinblastin, zur Bekämpfung schnellteilender Tumorzellen eingesetzt (Makowski, 1995; Arbuck et al., 1993). Neue Untersuchungen konnten bestätigen, daß Taxol direkt an die MT bindet, und zwar im Verhältnis von einem Molekül Taxol pro a/b-Heterodimer (Derry et al., 1995). Die Bindestelle befindet sich am Rande der Heterodimere, an der Grenze zu dem benachbarten Protofilament (Nogales et al., 1995b). Daher wird angenommen, daß Taxol die Interaktion zwischen den Protofilamenten in den MT beeinflußt. Weiterhin wurde mittlerweile in mehreren Untersuchungen bestätigt, daß Taxol die Festigkeit von MT erhöht (Mickey & Howard, 1995; Felgner et al., 1996).
Über die Wirkung von mikromolaren Taxol-Konzentrationen auf das Cytoskelett von Reticulomyxa besteht Uneinigkeit. Koonce et al. (1986) beobachteten keinen Effekt von 10 µM Taxol auf das RPN und auf den Partikeltransport bei in-vivo Experimenten, ebenso wie Koonce & Schliwa (1986), die lysierte RPNs in 20 µM Taxol inkubierten ohne Veränderungen des Cytoskeletts oder des reaktivierten Organellentransports beobachten zu können. Dahingegen beobachteten Hauser et al. (1989) eine Stabilisierung der MT und - bei Langzeitinkubationen mit 10 µM Taxol über mehrere Tage - eine Neusynthese von Tubulin, da tyrosiniertes Tubulin feststellbar war.
Bei der in Bezug auf die Cytoskelettorganisation sehr ähnlichen Foraminifere Allogromia laticollaris beobachtete Golz (1986) bei kurzfristiger Taxol-Applikation eine erhöhte MT-Ausbildung und eine Beschleunigung des intrazellulären Transports. Die Erhöhung der Transportgeschwindigkeit ist aber wahrscheinlich auf das Lösungsmittel DMSO zurückzuführen, da dieses ebenfalls zu beschleunigtem Partikeltransport in Allogromia führt (Golz, 1986).
Die im Rahmen der vorliegenden Arbeit durchgeführten Untersuchungen konnten keinen offensichtlichen Effekt kurzfristiger Taxolinkubationen auf das RPN von Reticulomyxa bestätigen. Weder schien sich die Ausbildung neuer Pseudopodien zu beschleunigen, noch schienen diese rigider oder mit mehr MT gefüllt zu sein. Die Langzeituntersuchungen ergaben auch nach mehrtägiger Taxolinkubation nur geringfügige Veränderungen in der Organisation des RPN. So zeigten sich - ebenso wie bei längeren Taxolinkubationen bei Allogromia - mehr lineare, protofilament-artige Strukturen, die parallel zu den MT verliefen. Die MT selber waren jedoch nicht gegen den Abbau stabilisiert, wie Versuche mit Kälteinkubationen Taxol-behandelter Zellen zeigten.
Während man sich den fehlenden Einfluß von Taxol auf die Polymerisationsrate von Tubulin noch damit erklären kann, daß nicht encystierte Zellen von Reticulomyxa möglicherweise nur einen geringen Pool freien Tubulins haben, das durch Taxol zu beschleunigtem Wachstum von MT beitragen könnte, verwundert allerdings die Kälte-Labilität Taxol-inkubierter MT. Schon bei deutlich geringeren Taxolkonzentrationen (5 µM) fanden Schiff et al. (1979), daß die MT bei Abkühlung auf 00C nicht mehr depolymerisierten. Thompson et al. (1981) konnten beobachten, daß Tubulin auch bei 00C durch Zugabe von Taxol zur Polymerisation gebracht werden konnte.
Für das Phänomen der Kälte-Labilität von Reticulomyxa-MT trotz Taxol-Inkubation gibt es zwei Erklärungsmöglichkeiten. Eine Erklärung wäre, daß Taxol die Zellmembran nicht passiert und deshalb nicht zur Wirkung gelangen kann. Das stünde allerdings in Gegensatz zu den Beobachtungen von Hauser et al. (1989), sowie zu den Untersuchungen an dem weitgehend analogen Organismus Allogromia.
Aus der Ultrastruktur ergäbe sich noch eine andere Erklärung: Die Taxol-Bindestelle liegt an der Grenze zwischen den Tubulin-Protofilamenten (Nogales et al., 1995b), stabilisiert also wahrscheinlich die Bindung zwischen benachbarten Protofilamenten. Der Abbau von MT zu helikalen Filamenten erfolgt jedoch anscheinend über die Lösung der longitudinalen Bindungen innerhalb der Protofilamente und erhält die lateralen Bindungen zwischen den Heterodimeren (Golz, 1986; Hauser & Schwab, 1974). (Zur Verdeutlichung dieses Phänomens helfen auch die Abbildungen auf S. 82.) Unter dieser Annahme ist das Fehlen einer MT-stabilisierenden Wirkung von Taxol bei Reticulomyxa nicht verwunderlich. Zumindest auf die Umwandlung von HF in MT und vice versa kann Taxol nach diesem Modell wahrscheinlich keinen Einfluß haben.
Dies bestätigten auch die im Rahmen dieser Arbeit durchgeführten Untersuchungen an Taxol-behandelten Zellen, die mit Magnesiumchlorid zur Bildung von helikalen Filamenten induziert wurden. Auf lichtmikroskopischer Ebene gab es keinen Unterschied zwischen Taxol-behandelten und Kontrollzellen, sowohl, was die Arretierung des Körnchentransportes, als auch, was seine Reaktivierung durch Auswaschen betraf. Lediglich die Form der gebildeten helikalen Filamente im elektronenmikroskopischen Bild scheint sich durch Taxol zu ändern, was auf die Bindung von Taxol an die HF zurückzuführen sein könnte.
Die plausibelste Schlußfolgerung aus den durchgeführten Untersuchungen ist, daß Taxol zwar in die Zellen eindringt - was sich an der geänderten Ultrastruktur der HF zeigt -, aber die Umwandlung von MT in HF und vice versa nicht behindert.
Die MT-depolymerisierenden Agenzien Colchicin und Nocodazol
Colchicin bindet in einer langsamen und labilen Reaktion an eine spezifische Bindestelle, die sich auf der b-Tubulin-Untereinheit der Heterodimere befindet (Wolff & Knipling, 1995; Bai et al., 1996), aber wahrscheinlich auch Teile des a-Tubulins betrifft (Wolff & Knipling, 1995). Die Bindung geht einher mit einer Konformationsänderung des Tubulins (Sackett & Varma, 1993), die wahrscheinlich die Polymerisation behindert. Die Affinitäten der Tubuline verschiedenen Ursprungs für Colchicin ist jedoch sehr unterschiedlich (Hastie, 1991) und kann auch innerhalb eines Organismus vom Entwicklungsstadium abhängen (Friedman et al., 1980, zitiert nach Hastie, 1991). Daher vermuten einige Autoren, daß die Modifikation der Colchicin-Bindestelle in vivo zur Regulation des MT-Aufbaus verwendet wird (Wilson et al., 1984).
Unter den zahlreichen Agenzien, die ebenfalls mit der Colchicin-Bindestelle interagieren (Hoebeke et al., 1976), ist die antimitotische Droge Nocodazol, die in dieser Arbeit eingesetzt wurde, eines der effektivsten MT-depolymerisierenden Agenzien (DeBrabander et al., 1976). Da Nocodazol die gleiche Bindestelle und den gleichen Wirkmechanismus wie Colchicin besitzt, hilft der Vergleich zwischen beiden Drogen, ihre Wirkung auf das RPN von Reticulomyxa zu verstehen.
Die Wirkung von Colchicin und Nocodazol auf Reticulomyxa und die morphologisch ähnliche Art Allogromia laticollaris ist grundsätzlich verschieden. Während Allogromia Colchicin-sensitiv ist und bei rund 1 mmolarer Applikation innerhalb einer Minute sämtliche MT abbaut (Golz, 1986), führt die gleiche Colchicin-Konzentration bei Reticulomyxa zu keiner Reaktion (Froese, 1990; Koonce et al., 1986).
Wie nach den Ergebnissen der Colchicinversuche zu erwarten war, erwies sich in dieser Arbeit das RPN von Reticulomyxa als Nocodazol-insensitiv. Auch Koonce et al. (1986) berichten, daß 10 µg/ml Nocodazol bei 24-stündiger Inkubation keinen Einfluß auf Struktur und Partikeltransport im RPN haben, eine Beobachtung, die ebenso von Hauser et al. (1989) indirekt bestätigt wird.
Die beobachtete Stabilität gegenüber Colchicin und Nocodazol könnte auch dadurch verursacht sein, daß diese Drogen in-vivo die Zellmembran nicht passieren können. Zwar konnten Koonce & Schliwa (1986) die MT lysierter Reticulomyxa-Zellmodelle durch die Applikation von 10 µM Nocodazol nicht abbauen, aber das dabei verwendete Lysismedium enthielt Hexylenglykol und Vanadat als MT-stabilisierende Zusätze. Im Rahmen der vorliegenden Arbeit wurde jedoch gezeigt, daß die Stabilität der MT auch dann durch Nocodazol nicht beeinflußt wird, wenn die Zellen mit einem nicht MT-stabilisierenden Medium lysiert werden.
Wie kann man sich die geringe Sensitivität der MT von Reticulomyxa gegenüber MT-abbauenden Agenzien erklären? Hauser et al. (1989) nennen in der Diskussion ihrer Arbeit die Möglichkeit, daß die MT von Reticulomyxa Nocodazol-stabil seien, weil sie zumeist aus Glu-Tubulin bestünden, das nach Wehland & Weber (1987) von Nocodazol nicht angegriffen werde. Da Nocodazol - wie auch Colchicin - an die freien Tubulin-Heterodimere bindet und diesen durch eine Konformationsänderung die Fähigkeit zur Polymerisation nimmt, verschiebt es die Reaktion des MT « Tubulin - Gleichgewichtes in Richtung des freien Tubulins. Davon nicht betroffen sind alle stabilen MT, die nicht mehr im Gleichgewicht mit freiem Tubulin stehen. Dies sind in aller Regel Glu-Tubulin reiche MT.
In der vorliegenden Arbeit konnte jedoch gezeigt werden, daß große Teile des Reticulomyxa-Tubulins zumindest mit einigen Anti-Tyr-Tubulin mAKs reagieren, so daß nicht zwangsläufig anzunehmen ist, daß es sich um stabile MT handle. Nähme man jedoch an, daß die meisten MT von Reticulomyxa zwar durch die in dieser Arbeit beschriebenen MTOCs gecapt seien, aber z.B. aufgrund einer schwachen Carboxypeptidase-Reaktion trotzdem Tyr-Tubulin enthielten, ließe sich damit die beobachtete hohe Colchicin- und Nocodazol-Stabilität erklären.
Diese Begründung wäre zwar in sich schlüssig, wurde aber schon unter umgekehrten Vorzeichen von Golz, (1986) gebraucht, der meinte, die Tyr-Tubulin reichen MT von Allogromia reagierten deshalb so empfindlich auf Colchicin und Nocodazol, weil sie nicht gecapt sein. In beiden Organismen kommen jedoch ähnliche MTOCs in gleichen Maßen vor, wenn man die Abbildungen in Golz & Hauser (1991) mit den vorliegenden (z.B.: Abb. 14) vergleicht. Die größeren Unterschiede sind in den Eigenarten der verschiedenen Tubulin-Isoformen (vergl. z.B. die Western-Blots in Hauser et al. (1989)) zu finden. Daher erscheint es immer noch am plausibelsten, die unterschiedliche Colchicin-Resistenz beider Organismen mit der unterschiedlichen Colchicinbindungsaffinität ihrer Tubuline zu erklären.
Da die Fähigkeit zur Colchicin-Bindung nicht nur zwischen verschiedenen Arten, sondern sogar innerhalb des gleichen Organismus in Abhängigkeit vom Entwicklungsstadium erheblich variieren kann (Friedman et al., 1980, zitiert nach Hastie, 1991), ist ein Unterschied zwischen den morphologisch ähnlichen aber phylogenetisch doch wahrscheinlich weiter entfernten Organismen Reticulomyxa und Allogromia durchaus möglich.
Die Wirkung von Kälte auf die Polymerisation von Mikrotubuli
Die meisten MT reagieren auf Temperaturabsenkungen mit Depolymerisation, die je nach Zellsystem unterschiedlich schnell erfolgt (Dustin, 1984). Trotzdem gibt es eine Reihe sekundär kälteangepaßter Organismen, deren MT auch bei Temperaturen um den Gefrierpunkt noch nicht depolymerisieren (Wallin & Stromberg, 1995; Singer et al., 1994; Margolis et al., 1990).
Die Ursachen dieser Kälte-Stabilität sind offenbar verschieden. In neuronalen Zellen scheint Kälte-Stabilität wesentlich mit dem Auftreten eines MAPs, dem sogenannten STOP (stable tubules only protein) assoziiert zu sein (Margolis et al., 1990). Dieses Protein ist Ca2+-Calmodulin reguliert (Pirollet et al., 1992) und bindet in Abwesenheit von Ca2+-Calmodulin an MT, die so gegen den Abbau durch Kälte stabilisiert werden.
Die MT mancher Organismen sind unter Umständen auch ohne stabilisierende MAPs kältestabil (Stromberg & Wallin, 1994). Versuche, dieses Phänomen einem bestimmten Bereich des Tubulins zuzuordnen, sind aber bislang fehlgeschlagen (Singer et al., 1994).
Interessanterweise müssen cytoplasmatische MT, die gegenüber depolymerisierenden Agenzien durchaus stabil sind, nicht auch zwangsläufig Kälte-stabil sein (Khawaja et al., 1988), so daß man für beide Vorgänge verschiedene Wirkmechanismen annehmen kann.
Reticulomyxa reagiert zwar auf Kältebehandlungen mit dem Rückbau des RPN und der teilweisen Überführung der MT in helikale Filamente, besitzt aber - ähnlich wie Allogromia (Golz, 1986) - zumindest eine Subpopulation kältestabiler MT (z.B. Abb. 29) und reagiert auf Kältebehandlungen mit nur teilweiser Reduktion des RPN. Die verbleibenden Pseudopodien und der Zellkörper sind mit einer deutlich erhöhten Anzahl HFs erfüllt.
Da Reticulomyxa auch bei Temperaturen knapp über dem Gefrierpunkt noch etliche MT aufweist, muß angenommen werden, daß diese MT Kälte-stabilisiert sind. Das wird auch durch Kälteversuche an lysierten Zellmodellen bestätigt. Die Ursache der Kältestabilität ist jedoch unklar. Es könnte sich wie bei einigen antarktischen Fischen um eine sekundär erworbene Eigenschaft, die durch spezielle MAPs oder Tubulin-Modifikationen vermittelt wird, handeln. Wallin und Stromberg (1995) weisen jedoch darauf hin, daß die Kälte-Labilität vieler Wirbeltier-MT wahrscheinlich selbst eine sekundäre Errungenschaft ist, da die evolutionär ersten Zellen sich bei deutlich niedrigeren Temperaturen als 370C entwickelt haben dürften. Daher ist die Kältestabilität der MT von Reticulomyxa wahrscheinlich als ein eher ursprüngliches Merkmal anzusehen.
Während die MT von Reticulomyxa bei in-vitro Versuchen an lysierten Zellen kältestabil sind, werden viele MT in-vivo unter Kälteeinfluß zu helikalen Filamenten abgebaut. Dies legt nahe, daß die Umwandlungen von MT in HF nicht direkt kälteinduziert ist, sondern erst auf ein intrazelluläres Signal hin erfolgt.
Die Wirkung von Calcium und des Calcium-Antagonisten Lanthan auf das MT-Cytoskelett
Calcium verhindert in vitro die Polymerisation von Tubulin (Weisenberg, 1973) und reguliert in vivo den intrazellulären MT-Umbau (Hepler, 1992; Vanduijn & Vanhaastert, 1992). Die Wirkung von Calcium erfolgt teilweise direkt auf das Tubulin über je eine hochaffine Ca-Bindestelle pro Tubulin-Monomer (Solomon, 1977), wird aber an den MT von MAPs moderiert , so daß in Abhängigkeit von den vorhandenen Tubulinen und den beteiligten MAPs verschiedene Grade von Calcium-Stabilität auftreten können (Stromberg & Wallin, 1994).
An der Wirkung von Calcium-Ionen auf das MT-Cytoskelett sind ebenfalls verschiedene Calcium-bindende Proteine beteiligt: In den Oocyten von Mäusen wird die Wirkung möglicherweise über einen speziellen Calcium-Transporter vermittelt, der mit den MT colokalisiert ist (Depennart et al., 1994); in Zellen der glatten Muskulatur sind die MT mit dem Calmodulin-bindenden Protein Caldesmon verbunden, das als MAP fungiert und die Polymerisationsrate von MT in der Abwesenheit von Calcium2+-Ionen erheblich steigert (Ishikawa & Kohama, 1992). Auch das schon mehrfach genannte STOP-MAP wird von Ca2+-Calmodulin reguliert (Pirollet et al., 1992) und fördert wie Caldesmon die Polymerisation von MT in der Abwesenheit von Ca2+-Calmodulin.
Aufgrund dieser vielfältigen Einflüsse von Ca2+-Ionen auf MT ist natürlich auch die Wirkung dieses Agens auf das Cytoskelett von Reticulomyxa von Interesse. Da der direkte extrazelluläre Einsatz millimolarer Konzentrationen von Ca2+-Ionen in vivo keinen Effekt auf das RPN hat, wurden in der vorliegenden Arbeit mit lysierten Zellmodellen gearbeitet. Dabei zeigte sich, daß die MT von Reticulomyxa eine Behandlung mit bis zu 2mM CaCl2 problemlos überstehen, während die stabilen MT anderer Organismen bei gleicher Behandlung depolymerisieren (Mütze et al., 1996).
Da die Tubulin-Isolation bei Reticulomyxa nicht gelang, kann hier nicht gesagt werden, ob es sich um einen Effekt handelt, der auf spezifischen MAPs beruht, oder ob die Calcium-Stabilität eine Eigenschaft des Tubulins selbst ist.
Als weiteres Indiz für die Ca2+-Insensitivität des MT-Cytoskeletts von Reticulomyxa können die Versuche mit Lanthan-Ionen gewertet werden. Wenn eine Abhängigkeit von extrazellulärem Ca2+ vorläge, müßte die Inkubation mit La3+ deutliche Effekte auf das Cytoskelett haben, da La3+ viele Zelloberflächenkomponenten insbesondere alle Ca2+-Kanäle und die membranständigen Na+/Ca2+ Austauscher (Baker, 1986) blockiert.
Tatsächlich zeigen die Zellen von Reticulomyxa eine sehr spezifische Reaktion auf geringe (0,2mM) Konzentrationen an Lanthan-Ionen. Dabei können zwei Wirkungsweisen unterschieden werden:
Zum einen scheint Lanthan direkt auf die Membran zu wirken und diese zu schädigen (Abb. 38). Dies verwundert nicht, da Lanthan viele Ionenkanäle (Baker, 1986) bindet, weswegen es in der elektronenmikroskopischen Technik als genereller Marker für kleine Poren eingesetzt wird (Plattner & Zingsheim, 1987). Außerdem reagiert Lanthan auch mit Mucopolysaccharid-Protein Komplexen und wurde deshalb vereinzelt zu deren elektronenmikroskopischen Kontrastierung eingesetzt (Khan & Overton, 1970). Auch das Auftreten außergewöhnlich stumpfer Pseudopodien bei Reticulomyxa-Zellen, die nach Inkubation in 0,5 mM Lanthan wieder ausgewaschen wurden (Abb. 37) kann durch direkte Membranwirkungen erklärt werden.
Auf der anderen Seite sind auch intrazelluläre Effekte von Lanthan beobachtbar Während die Zahl und die Ultrastruktur der MT sich nicht verändert, wird das Plasma elektronendichter kontrastiert (vgl. Abb. 38 und 39). Möglicherweise hat sich hier im Verlauf der Fixierung Lanthan eingelagert und ist aufgrund seiner hohen Ordnungszahl (Lanthan hat die Ordnungszahl 57 und ein Atomgewicht von 138 Da.) direkt im Elektronenmikroskop sichtbar geworden.
Da die Inkubation in 0,2 mM Lanthan sowohl den MT-gebundenen Transport als auch die Arbeit kontraktiler Vakuolen - ähnlich wie 2,4 Dinitrophenol (Froese, 1990) - hemmt, muß eine zentraler Ort des Energiestoffwechsels betroffen sein. Da La3+ bei anderen Zellen die Membran nicht passieren kann und den Energiestoffwechsel nicht beeinträchtigt (Morley & Whitfield, 1993) läßt sich diese außergewöhnliche toxische Wirkung ohne weitere Versuche nicht erklären.
Übergänge zwischen den Tubulin-Aggregationsformen
Seit das MT-Cytoskelett der Foraminiferen und der nahe verwandten Art Reticulomyxa näher untersucht worden ist, hat die Frage der Bildung von helikalen Filamenten die Beobachter beschäftigt. Schon 1974 bestätigten die Versuche von Hauser und Schwab (1974), daß die helikalen Filamente in Allogromia aus Tubulin bestehen, ein Befund, der durch alle späteren Untersuchungen, z.B. durch Antikörper von Rupp et al. (1986) stets bestätigt wurde.
Vinca-Alkaloide und die Entstehung helikaler Filamente
In ihren Untersuchungen an der Foraminifere Allogromia beobachteten Hauser und Schwab (1974), daß die durch Vinblastin erzeugten helikalen Tubulin-Filamente den in diesem Organismus natürlicherweise vorkommenden gleich waren. Das legte nahe, daß eine große Ähnlichkeit zwischen der Wirkung von Vinca-Alkaloiden und den physiologischen Vorgängen, die zur Bildung helikaler Filamente in Allogromia oder Reticulomyxa führen, besteht.
Vinca-Alkaloide können sowohl an freie Heterodimere, als auch an MT binden, da die Heterodimere über je eine hoch- und niedrigaffine Bindestelle für die Alkaloide verfügen (Review in Himes, 1991.) Freies Tubulin polymerisiert in Gegenwart von Vinblastin in Form von helikalen Filamenten. In Abwesenheit von MAPs und bei niedrigen Magnesiumkonzentrationen formen sich dabei einfache helikale Filamente von 6 nm Dicke. In Gegenwart von mehr als 6 mM Magnesium oder von MAPs formen sich doppelte Filamente (Nogales et al., 1995a). Das legt nahe, daß die helikalen Filamente, die durch Vinblastin gebildet werden, den Protofilamenten der MT entsprechen; anders kann die Bildung einfacher Filamente nicht erklärt werden.
Auch MT können durch Vinblastin in HF überführt werden. Während eine geringe Vinblastin-Konzentration durch Bindung an die hochaffine Bindestelle die dynamische Instabilität von MT einschränkt oder diese depolymerisiert (Himes, 1991), bindet die Droge bei höheren Konzentrationen an die niederaffine Bindestelle und führt durch Interaktion zwischen den Tubulinmolekülen eines Protofilaments zur Aufspiralisierung der Protofilamente in HF. Dieser direkte Übergang ohne vorhergehende MT-Depolymerisation kann in vitro an MT beobachtet werden von deren Enden sich zahlreiche HF aufspiralisieren. (Vgl. Fig. 6 in (Himes, 1991).)
Inwieweit die Ergebnisse von in-vitro Versuchen den in-vivo Verhältnissen gerecht werden, ist jedoch nicht gänzlich geklärt. So beobachteten Behnke und Forer (1972), daß Vinblastin in den Spermien von Nephrotoma die cytoplasmatischen MT in HF umwandelt. Dabei entstand pro MT ungefähr 1 HF, während nach den Ergebnissen der in-vitro Versuche mit 7 HF zu rechnen wäre. Die entstandenen HF behalten sogar die Brückenbindungen an den von ihnen umgebenen Zellkern bei; auch das wäre bei dem in-vitro Modell der Aufspiralisierung einzelner Protofilamentpaare unmöglich.
Ultrastruktur helikaler Filamente in Vertretern der Granuloreticulosea
Im Gegensatz zu den in-vitro Untersuchungen mit Vinblastin erfolgt nach Ansicht der meisten damit befaßten Autoren die Umwandlung der MT in Allogromia und Reticulomyxa nicht durch Aufspiralisierung von den Enden her, sondern durch einen Reißverschlußmechanismus, wie er von Hauser und Schwab (1974) erstmalig vorgeschlagen wurde (vgl. die folgende Abbildung) und auf den sich auch neuere Publikationen immer noch berufen (Golz, 1986; Welnhofer & Travis, 1996).
Da alle neueren Untersuchungen zur Ultrastruktur von MT (Song & Mandelkow, 1995; Kikkawa et al., 1994; Mandelkow et al., 1986) zu dem Ergebnis kommen, daß MT stets von einer 3-Start linkshändigen Heterodimerspirale gebildet werden, und nicht von einer 2-Start Helix, wie dies das Modell von Hauser und Schwab impliziert, muß das ursprüngliche Modell leicht verändert werden, was die folgende Abbildung verdeutlichen soll.
Fig. 13 Die zwei Modelle zur direkten Entstehung von helikalen Filamenten aus MTDas linke Modell nach Hauser und Schwab (Hauser & Schwab, 1974) geht von einem 2-Start linkshändigen MT aus, während das rechte Modell von einem 3-Start MT ausgeht. Der MT im rechten Bild besitzt einen Saum aus andersartigen Bindungen zwischen den Protofilamenten 1 und 13. Der Abstand zwischen der ersten Windung des HF und dem Ende des MT beträgt ca. 4 nm und müßte durch einen noch unbekannten Prozeß geschlossen werden, da er im fertigen HF nicht mehr vorliegt. |
 |
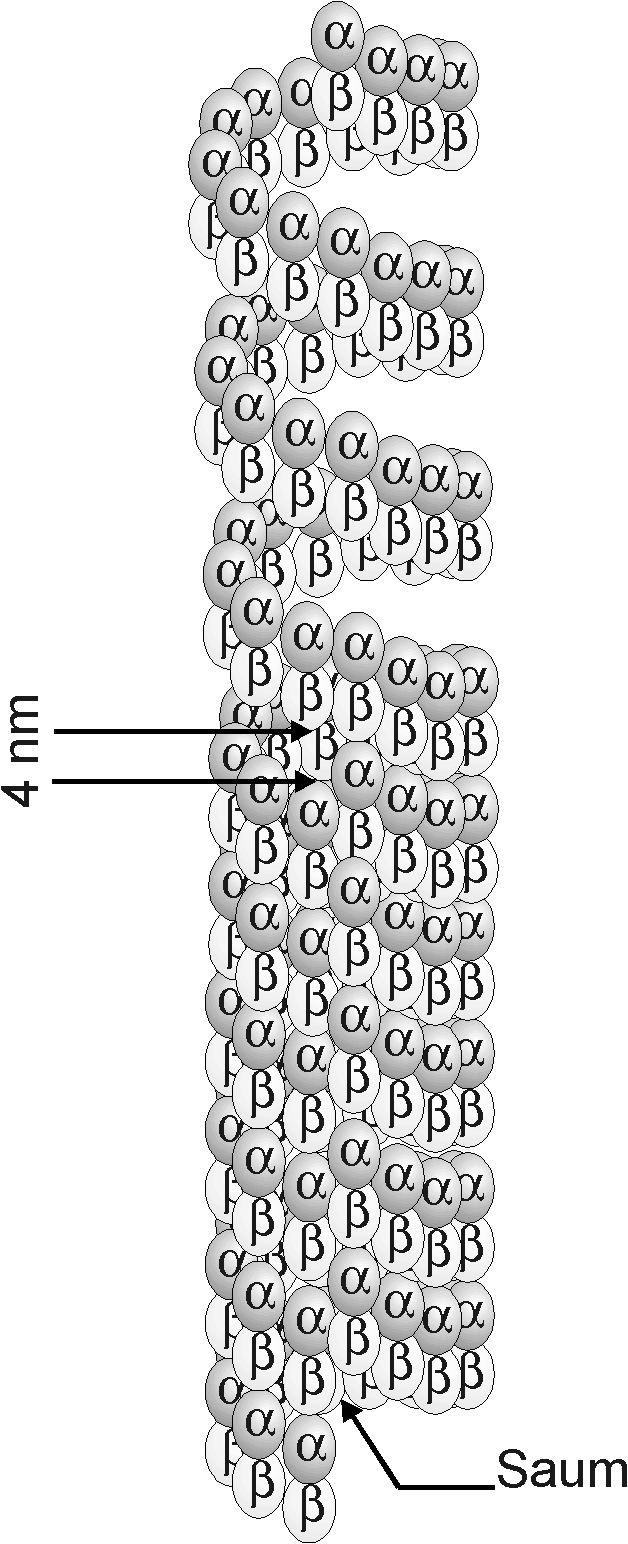 |
Die 3-Start helikale Anordnung hat zur Folge, daß an einer Stelle des MT, dem sogenannten "Saum" die Heterodimere gegeneinander um ungefähr 4 nm versetzt sind. Würde sich aus einem solchen MT durch direkten Übergang ein HF entwickeln, sollte dieses ebenfalls eine Stelle besitzen, an der ein Versatz zwischen benachbarten Heterodimeren zu erkennen ist. Daß dies nicht der Fall ist, zeigen die Untersuchungen an negativ kontrastierten helikalen Filamenten von Golz und Hauser (1986) an Allogromia, sowie von Schulz (1991) an Reticulomyxa.
Wenn man annimmt, daß sich die MT der Granuloreticulosea tatsächlich direkt in HF umformen, muß dieser Gangunterschied der Tubulin-Helix berücksichtigt werden; im einfachsten Fall muß also außer dem Lösen der longitudinalen Bindungen innerhalb der Protofilamente eine Verschiebung um 4 nm entlang des Saumes vermutet werden. Möglicherweise ergibt sich diese Verschiebung automatisch dadurch, daß die resultierende Konformation energetisch günstiger ist.
Direkte Umwandlung von Mikrotubuli in helikale Filamente
Die Untersuchungen zur vorliegenden Arbeit haben gezeigt, daß durch Applikation von 20 mM Magnesiumchlorid innerhalb von 30 Sekunden der intrazelluläre Transport gestoppt wird und sich die MT in HF umwandeln. Diese Umwandlung setzt von der Peripherie der Pseudopodien her ein und schreitet im Verlauf mehrerer Minuten in das Innere der Zellausläufer hin fort. Noch nicht umgewandelte MT kurzzeitig behandelter Zellen erscheinen im EM-Bild häufig mit einer distinkten Schrägstreifung, die an die Struktur der HF erinnert. Dies, die große Geschwindigkeit der Umformung, sowie das Fehlen anderer Übergangsstadien sprechen dafür, daß die Umwandlung über die gesamte Länge eines MT erfolgt.
Durch die Transformation in HF über die gesamte Länge des MT ist die Zelle offenbar in der Lage, MT wesentlich schneller als bei der sonst üblichen end-abhängigen Depolymerisation abzubauen. Diese Annahme vertreten auch Welnhofer und Travis (Welnhofer & Travis, 1996), die in neueren Versuchen - ebenfalls mit Magnesiumchlorid - die Umwandlung von MT in HF in Allogromia untersuchten.
Welnhofer und Travis (1996) fanden bei Allogromia, daß der Umwandlungsprozeß von HF in MT unabhängig von der Zufuhr von Stoffwechselenergie in Form von ATP ist. Die vorliegende Arbeit kommt bei den MT von Reticulomyxa zu dem gleichen Ergebnis. DNP-behandelte Zellen sind immer noch in der Lage gewesen, ihre MT bei MgCl2-Zugabe in HF umzuwandeln. Selbst nach einer Lysisbehandlung wurden die MT von Reticulomyxa noch durch Magnesiumchlorid abgebaut.
Die Wirkungsweise von Magnesiumchlorid ist zur Zeit noch unklar. Diese Untersuchung basiert auf Experimenten von Shigenaka et al. (Shigenaka et al. 1974, zitiert nach Dustin, 1984) an Echinosphaerium nucleofilium. Die Autoren stellten fest, daß Magnesiumionen bei diesem Objekt in vivo zur Bildung von helikalen Filamenten führen. Die Behandlung mit 20 mM Magnesiumchlorid wurde später von Koonce et al. (1986) bei Reticulomyxa zur Arretierung des cytoplasmatischen Transports eingesetzt, wobei die Autoren keine Angaben über die Auswirkungen auf das Cytoskelett der Amöbe machten. Bei Allogromia führen höhere (165 mM) Konzentrationen von Magnesiumchlorid ebenfalls zum Erliegen der Körnchenströmung und zu der Bildung helikaler Filamente (Welnhofer & Travis, 1996; Rupp et al., 1986).
In den Untersuchungen zu dieser Arbeit wurde deutlich, daß es sich nicht um einen spezifischen Effekt von Magnesiumchlorid handelt, sondern daß eine Vielzahl von Salzen den gleichen Effekt herbeiführen kann. Daher ist es unwahrscheinlich, daß die Reaktion auf diese Salze durch spezielle Magensiumkanäle in der Zellmembran verursacht wird. Möglicherweise reicht zur Induktion der Umwandlung von MT in HF ein Überschuß an Kationen, wie es die Untersuchungen von Golz und Hauser (1986) an Allogromia mit dem Polykation Rutheniumrot nahelegen. Die Umwandlung selber scheint nach den vorgelegten Versuchen mit DNP und lysierten Zellmodellen jedoch nicht energieabhängig zu sein.
Umwandlung von helikalen Filamenten in MT
Während die direkte Umwandlung von MT in HF als bewiesen angesehen werden kann, steht der Beweis für die Umkehrrekation allerdings noch aus. Werden MgCl2-behandelte Zellen wieder in Kulturmedium überführt, so wird die Rückumwandlung wahrscheinlich durch terminale MTOCs initiiert.
Das Plasma von Reticulopodien, die erneut MT ausbilden, zeichnet sich durch das gehäufte Auftreten kurzer MT mit terminalen MTOCs aus (Abb. 55, 56). Ob die terminalen MTOCs helikale Filamente oder freie Heterodimere für den Aufbau von MT verwenden, läßt sich nicht zweifelsfrei beweisen. Die Versuche mit Taxol-behandelten Zellen legen jedoch nahe, daß in vivo auch helikale Filamente direkt zum Aufbau von MT benutzt werden können, da Taxol die Dissoziation der HF in freies Tubulin verhindern sollte.
Die direkte Umwandlung von HF in MT hätte für die Zellen wahrscheinlich erhebliche Vorteile, da neue MT schneller und möglicherweise auch mit geringerem Energieaufwand aufgebaut werden könnten.
Auf der Grundlage der durchgeführten Versuche entstand das folgende Modell über die MT-Dynamik in Reticulomyxa, das im Wesentlichen mit den Modellen von Golz 1986) und Welnhofer und Travis (1996) identisch ist.
Fig. 14 Dynamik von Mikrotubuli in Reticulomyxa und verwandten GranuloreticuloseaDie folgenden Vorgänge wurden beobachtet oder werden vermutet: a/b: Normale Depolymerisation und Polymerisation sind wahrscheinlich, da zumindest Cysten über einen Pool an freiem Tubulin verfügen. c: Mikrotubuli können sich auf ganzer Länge in HF umwandeln. Der umgekehrte Vorgang d ist nicht bewiesen und kann nur vermutet werden. e: sehr wahrscheinlich ist, daß die sehr fragilen helikalen Filamente in freies Tubulin überführt werden können. f/g: Die Aggregation / Deaggregation überführt HF in größere Tubulin-Parakristalle. h: möglicherweise werden die Parakristalle direkt in freies Tubulin überführt. |
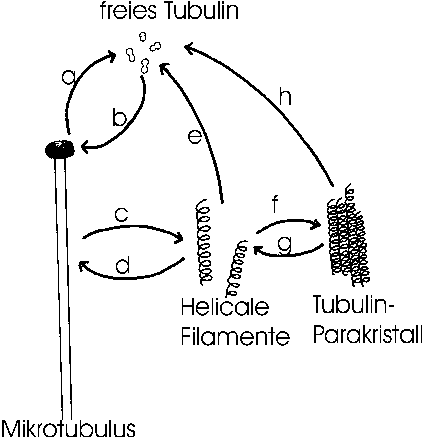 |
Das Actin-System
Neben Tubulin ist Actin auch bei Protisten als Bestandteil des Cytoskeletts weit verbreitet. Dahingegen sind Intermediärfilamente, wie sie bei Metazoen weit verbreitet sind, bei Protisten mit wenigen Ausnahmen (Ruthmann & Noll-Altmann, 1980; Mohr et al., 1990) bisher nicht nachgewiesen. Bei der Foraminifere Allogromia haben elektronenmikroskopische und immunologische Untersuchungen ebenfalls keine Intermediärfilament-ähnlichen Strukturen lokalisieren können (Lee & Anderson, 1991).
Ebenso wie Tubulin liegt monomeres G-Actin in den Zellen im Gleichgewicht mit seiner polymeren Form, dem F-Actin, vor. Allerdings sind Actinfilamente bei den herrschenden intrazellulären Verhältnissen wesentlich stabiler als MT und die kritische Konzentration für den Aufbau in der polymeren Form ist wesentlich geringer, so daß im Regelfall der Großteil des Actins als Polymer vorliegen dürfte (Carlier, 1991).
Die beiden Formen des Actins lassen sich getrennt nachweisen (Haugland et al., 1994): G-Actin läßt sich spezifisch mit DNAse I markieren (Haugland et al., 1994), während in dieser Arbeit F-Actin mit dem Pilzgift Phalloidin aus Amanita phalloides selektiv (Wieland, 1977) dargestellt wurde. Das Phalloidin wurde mit dem Fluoreszenzfarbstoff Rhodamin gekoppelt, um die Actinfilamente im Lichtmikroskop darstellen zu können (Wulf et al., 1979). Einige Indizien weisen jedoch darauf hin, daß Phalloidin nicht nur Actinfilamente stabilisiert, sondern auch das Gleichgewicht zwischen G- und F-Actin in Richtung des letzteren verschiebt (Lebihan & Gicquaud, 1991). Mit den meisten herkömmlichen Antikörpern gegen Actin werden beide Zustände des Proteins markiert. Diese Darstellung wurde schon zuvor von einigen Autoren bei der Untersuchung des Actin-Cytoskeletts von Reticulomyxa eingesetzt und wurde auch im Rahmen dieser Arbeit in Kontrollversuchen ausgetestet.
Bei der amöboiden Bewegung mit Hilfe von Actin sind zwei Grundmuster erkennbar: Bei vielen mit dicken Pseudopodien ausgestatteten Zellen erfolgt die Bewegung mit Hilfe eines corticalen Actinlayers, der durch Kontraktion das Plasma vorwärts preßt (Skalak et al., 1993), wie besonders am Beispiel von Amoeba proteus von verschiedenen Labors nachgewiesen wurde (Hauser, 1978; Yanai et al., 1996). Die Zellfortbewegung mit Hilfe feinerer Filopodien, wie sie z.B. bei den Wachstumskegeln von Neuronen (Sheetz et al., 1992), Fisch-Keratocyten (Euteneuer & Schliwa, 1984) oder Fibroblasten vorkommt, beruht jedoch vermutlich auf der lokalen Polymerisation von Actin an den Orten des Filopodienwachstums (Theriot & Mitchison, 1991), sowie dem aktiven Vorwärtsschieben bereits gebildeter Filamente (Cramer & Mitchison, 1993).
Actin hat außerdem eine wichtige Rolle bei der Substratanheftung von Zellen (Review in Jockusch et al., 1995). Über eine Vielzahl möglicher Interaktionspartner wie Vinculin, Talin, VASP, a-Actinin etc. sind die Actinfilamente in der Zellmembran mit speziellen Verankerungsproteinen (zumeist Integrine) verbunden. Die Integrine ihrerseits vermögen mit einer Vielzahl extrazellulärer Matrixproteine zu reagieren und vermitteln so die Adhäsion der Zellen.
In den letzten Jahren hat sich zunehmend herausgestellt, daß das Actin- und das Tubulin-System eng miteinander verbunden sind. Zahlreiche MAPs haben die Fähigkeit, auch Actinfilamente zu binden (Pedrotti et al., 1994; Leesmiller et al., 1992; Moraga et al., 1993; Ferralli et al., 1994; Collings et al., 1996; Ferhat et al., 1996) und gewährleisten so eine effektive Vernetzung der Cytoskelett-Komponenten.
Die Bedeutung von Actin im Cytoskelett von Reticulomyxa
Im Gegensatz zu den in dieser Arbeit gezeigten Ergebnissen ist die Verteilung von Actin im Cytoskelett von Reticulomyxa bislang als linear und MT-ähnlich beschrieben worden. Einleitende Untersuchungen von Koonce et al. (1986) mit Anti-Actin Antikörpern zeigten eine weitestgehende Kolokalisation beider Cytoskelettelemente. Lindenblatt (1988) kam zu ähnlichen Ergebnissen, zeigte aber durch Densitometermessungen, daß die Fluoreszenzmuster von MT und Actin nur ähnlich, jedoch nicht deckungsgleich sind. Während Koonce und Schliwa (1985) anfangs noch vermuteten, daß Actin als Antagonist zu MT-assoziierten Motorproteinen eine Rolle beim Organellentransport von Reticulomyxa spielen könnte, zeigte sich in späteren Untersuchungen (Koonce & Schliwa, 1986), daß dieser ausschließlich MT-gestützt und an eine spezielle Form cytoplasmatischen Dyneins gekoppelt ist (Schliwa et al., 1991).
Die bislang beobachtete ähnliche Verteilung von Actin und MT im RPN von Reticulomyxa steht im Widerspruch zu den meisten Untersuchungen an der Foraminifere Allogromia. Dort wiesen Bowser et al. (Bowser et al., 1988; Travis & Bowser, 1986; Travis & Bowser, 1987) mit Hilfe von Fluorochrom-konjugiertem Phalloidin nach, daß Actinfilamente zwar auch gelegentlich parallel zu MT angeordnet seien; die Hauptmenge des Actins war jedoch nicht mit Tubulin colokalisiert, sondern in einzelnen Punkten, vornehmlich Anheftungsstellen, aufzufinden. Die Fokussierung von Actinfilamenten auf focal-contact-ähnliche Anheftungsstellen konnten die Autoren ebenfalls im Hochspannungs-EM nachweisen (Bowser et al., 1988). Diese Untersuchungen stehen in Widerspruch zu den Beobachtungen von Golz (1986), der mit Hilfe verschiedener Anti-Actin mAK eine überwiegend diffuse Verteilung mit zusätzlicher linearer Kolokalisation von Actin und Tubulin, sowie eine Assoziation von Actin mit intrazellulären Membranen diagnostizierte.
Die Untersuchungen zur Actin-Lokalisation in Allogromia macht klar, daß die Ursache der widersprüchlichen Angaben letztlich auf der unterschiedlichen Methodik des Actinnachweises beruhen. Autoren, die - unabhängig vom Objekt - monoklonale Antikörper verwenden, kommen zu einer diffusen bis linear MT-parallelen Anordnung der Actinfilamente, während der Nachweis mit Rhodamin-Phalloidin sehr viel differenziertere Strukturen ausweist.
Dieses Phänomen ist möglicherweise auf eine noch unbekannte Eigenart des Actins von Reticulomyxa und Allogromia zurückzuführen, denn in anderen Organismen entspricht die Anti-Actin Markierung zumeist der Phalloidin-Markierung, enthält aber zusätzlich noch eine, meist diffus verteilte, Fluoreszenz durch nicht polymerisiertes G-Actin (z.B.: Haugland et al., 1994). Da die meisten Anti-Actin mAK gegen Actin aus Muskeln hergestellt wurden (Jockusch et al., 1995), sind möglicherweise die Differenzen zwischen Anti-Actin und Phalloidin-Markierung dadurch zu erklären, daß eine oder mehrere Actin-Isoformen in Reticulomyxa durch kommerzielle Antikörper nicht nachgewiesen werden können.
Die folgende Schemazeichnung faßt die in dieser Arbeit gewonnenen Ergebnisse über die Lokalisation und Funktion von Actin zusammen:
Fig. 15 Actinorganisation im RPN von ReticulomyxaDas gesamte RPN ist von feinen Actinfilamenten durchzogen. Zusätzlich findet man: a: Actinfilamentbündel an Verzweigungen und sich aufrichtenden Reticulopodien b: Actinsäume an Lamellipodien; teilweise auch mit actingestützten Filopodien c: wurzelförmige Actinaggregate an größeren Plasmamassen im RPN d: Anheftungsstellen, die mit Actin stabilisiert sind |
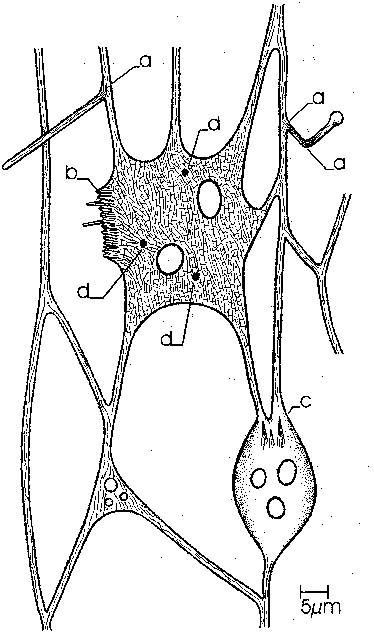 |
Einzelne Actinfilamente sind ein wesentlicher Bestandteil des Cytoskeletts von Reticulomyxa. Sie folgen in den linearen Bereichen des RPN der Orientierung der Reticulopodien und sind daher dort oft ähnlich verteilt wie die Mikrotubuli. Diese Actinfilamente wurden schon von Lindenblatt (1988) in der IIF mit Hilfe von Anti-Actin nachgewiesen; in elektronenmikroskopischen Bildern von lysierten und S1-Fragment-dekorierten Reticulopodien konnte er zeigen, daß in diesen die Actinverteilung ebenso wie die der MT größtenteils linear ist. Zu ähnlichen Bildern kamen auch Koonce und Schliwa (1986) mit Hilfe der Anti-Actin IIF und der S1-Dekoration von Actinfilamenten im Hochspannungs-EM.
Nachdem von Koonce und Schliwa in der oben zitierten Arbeit geklärt wurde, daß Actin nicht an dem Organellentransport beteiligt ist, stellt sich die Frage, welche Funktion Actin im RPN von Reticulomyxa erfüllt. Es werden drei Typen des intrazellulären Transports in Reticulomyxa unterschieden (Koonce et al., 1986):
- cytoplasmatische Strömung,
- saltatorischer Organellentransport, und
- laterale Bewegung.
Die Transporttypen b) und c) sind MT-gestützt, wohingegen Koonce und Schliwa (1986) die cytoplasmatische Strömung für Actin-vermittelt halten. Bei Allogromia sieht Golz (1986) nach Untersuchungen mit CytochalasinB die Hauptfunktion des Actins in dem "Aufbau eines cytoplasmatischen Grundgerüstes ... das alle Organellen der Pseudopodien an die von den MT getragenen Bewegungsprozesse anbindet." Ähnlich beurteilen diesen Sachverhalt auch Travis und Bowser (1986), die u.a. von der "Koordination der verschiedenen MT-abhängigen Prozesse" sprechen.
Diese Koordinations- und Vermittlungsrolle scheint mithin auch die wahrscheinlichste Aufgabe für die einzelnen Actinfilamente zu sein, die parallel zu den MT in den einzelnen Strängen des RPN und breit gestreut in den Lamellipodien liegen.
Davon unterschieden sind Actinfilamentbündel, die man gelegentlich an Verzweigungen oder unterhalb der Spitzen von Pseudopodien findet (Abb. 60 und 62). Da solche Verzweigungen häufig vom Substrat abgehoben sind, ist die wahrscheinlichste Rolle für Actinfilamente an dieser Stelle die Stabilisation von Verzweigungen und die Aufrichtung von abgezweigten Pseudopodien gegen die Schwerkraft. Während die horizontale Verzweigung des RPN im wesentlichen von dem MT-Cytoskelett abhängig zu sein scheint (Koonce et al., 1987) fehlt eine plausible Begründung, wie sich einzelne, unter Umständen nur einen Mikrotubulus enthaltende, Reticulopodien gegen die Schwerkraft ohne die Hilfe eines Zugkraft entwickelnden Cytoskelettbestandteiles aufrichten könnten.
Da von diesen Filamentbündeln allem Anschein nach Kraft auf Zellfortsätze ausgeübt wird, ist anzunehmen, daß auch Motorproteine an diesen Filamenten beteiligt sind, ähnlich wie dies für die Stressfasern in Gewebekulturzellen nachgewiesen worden ist (Langanger et al., 1986). Biochemische Nachweise von Myosin sind bei Reticulomyxa jedoch nicht durchgeführt worden, so daß für diese Behauptung der Beweis aussteht.
Wie die Actinfilamentbündel bei Verzweigungen einzelner Pseudopodien, so scheinen wurzelförmige Actinaggregate bei größeren Plasmamassen an der Entstehung von Zugkraft beteiligt zu sein. Obwohl diese Aggregate eine entfernt Ähnlichkeit mit Stressfasern haben, handelt es sich wahrscheinlich nicht um solche. Während die Enden von Streßfasern in fokalen Kontakten verankert sind (Jockusch et al., 1995), sind die Enden dieser Actinaggregate häufig nicht direkt mit dem Untergrund verbunden, wie durch Beobachtungen im Reflexionskontrast gezeigt werden konnte.
Es ist anzunehmen, daß die wurzelförmigen Actinaggregate dem Transport von Plasmamassen relativ zum restlichen Zellkörper dienen. Gelegentlich scheint dabei ein direkter Kontakt zum Substrat hergestellt zu werden, der im Reflexionskontrast deutlich sichtbar wird, im Gegensatz zu typischen Streßfasern jedoch nicht der Zellfortbewegung oder -ausbreitung dient.
Die fein ausgezogenen Actinsäume vieler Lamellipodien, die mit Rhodamin-Phalloidin dargestellt werden konnten, sind offenbar eine Besonderheit bei Reticulomyxa. Vergleichbare Strukturen konnten weder von Bowser et al. (1988), noch von Golz (1986) in Allogromia gefunden werden. An diesen Stellen scheinen sich die außergewöhnlich dünnen (50 - 100 nm) Lamellipodien ausschließlich durch die Ausbildung von Actinfilamenten zu verbreitern. Vergleichbare Strukturen lassen sich in der Tubulin-IIF nicht nachweisen, und auch das elektronenmikroskopische Bild (Abb. 65) zeigt in dem Erweiterungsbereich solcher Säume keine MT. Stattdessen finden sich sowohl in der Phalloidin-Markierung, als auch im Elektronenmikroskop, Actinfilamente, die senkrecht zur lamellipodialen Front gerichtet sind und teilweise (Abb. 65) direkt in ihr zu inserieren scheinen.
Ähnliche Actinsäume konnten Euteneuer und Schliwa (1984) in der Migrationsfront von Keratocyten nachweisen. Dort sind sie nachweislich ohne unterstützende MT Träger der Zellfortbewegung (Theriot & Mitchison, 1991). Ähnlich verhält es sich in lokomotorisch aktiven Fibroblasten (Symons & Mitchison, 1991), in denen die Fronten der Lamellipodien durch die lokale Polymerisation von Actin vorgetrieben werden, und in Leukocyten, deren Bewegung ebenfalls durch Actinpolymerisation an der Migrationsfront angetrieben werden soll (Skalak et al., 1993).
Cramer und Mitchison (1993) fanden hingegen auch Beweise für die Vergrößerung lamellipodialer Fronten durch den gerichteten Transport von Actinfilamenten. Die Actinsäume sich ausbreitender postmitotischer PtK2 Zellen erweitern sich über den Transport von Actinfilamenten, nicht durch ihre distale Verlängerung. In wieweit dieses Modell auch für die Actinpolymerisation in lokomotorischen Zellen Gültigkeit hat, ist zur Zeit noch unklar.
In Reticulomyxa kommt den Lamellipodien und ihren Actinsäumen aller Wahrscheinlichkeit nach jedoch keine lokomotorische Bedeutung zu, da sie sich stets in den zentraleren Bereichen des RPN, weit entfernt von der Migrationsfront der Zelle, befinden. Die Reflexionskontrastbilder solcher Säume zeigen zwar häufig, daß sich an ihrem Rand Zelle und Substrat berühren, aber die leichte Ablösung dieser Säume in fixierten Zellen sowie das elektronenmikroskopische Bild quergeschnittener Lamellipodien zeigen, daß es sich nicht um großflächige Anheftungsstellen handeln kann.
Actin vermittelte Anheftungsstellen kommen im RPN von Reticulomyxa nur in geringer Zahl vor. Sie bestehen aus nur µm großen Actinplaques und befinden sich zumeist in den großen Lamellipodien, gelegentlich aber auch in Pseudopodien. Ihre Lebensdauer ist ähnlich der von Lamellipodien sehr begrenzt; kleinere Lamellipodien bestehen oft nur für wenige Minuten, größere unter Umständen einige Stunden.
Die Beurteilung, ob es sich bei einer Struktur um eine Anheftungsstelle handelt, ist indes nicht einfach. Beiweitem nicht jeder Substratkontakt, der im Reflexionskontrast nachgewiesen wird, ist auch mit Actinfilamenten verknüpft. Es gibt sowohl Substratkontakte, die nicht mit Actinfilamenten assoziiert sind (Abb. 72), als auch nur temporäre Berührungsstellen zwischen Zelle und Substrat, die durch den Druck größerer Zellorganelle entstehen.
Nach Jockusch et al. (1995) werden bei kultivierten Gewebekulturzellen zwei Typen von Anheftungsstellen unterschieden: "Fokale Anheftungsstellen" oder "Fokale Kontakte", die relativ großen, terminalen Anheftungsstellen von Streßfasern, die oft über Stunden oder Tage bestehen, und sogenannte "Podosomen", die kleiner sind und nur vorübergehend Bestand haben.
Wenn man die actinhaltigen Anheftungsstellen von Reticulomyxa in diese an Gewebekulturzellen entwickelte Systematik einordnen will, so kann es sich nur um Podosomen handeln, da sie a) nur für eine kurze Zeitdauer bestehen, b) nicht die terminalen Anheftungsstellen von Streßfasern sind und c) nicht mit dem für fokale Kontakte typischen Protein Vinculin (Schliwa & Potter, 1986; Dunlap et al., 1996) ausgestattet sind.
Bei der Foraminifere Allogromia sind Anheftungsstellen größtenteils auf wenige zentrale Orte beschränkt (zumeist die erstmaligen Substratkontakte großer Pseudopodien (Bowser et al., 1988)). Es fehlen, ebenso wie bei Reticulomyxa, zahlreiche und dauerhafte Anheftungsstellen in der Fläche des RPN, was die Arbeit mit Allogromia u. U. sehr erschweren kann, weil die Zellen sich leicht vom Substrat ablösen und zusammenziehen (Golz, 1986; Welnhofer & Travis, 1996). Bei der wesentlich größeren Foraminifere Amphisorus hemprichii beobachteten Travis und Bowser (1988) hingegen sogar typische fokale Kontakte, die in der Lage sind, mit erheblicher Kraftentfaltung am Substrat zu ziehen.
Aus diesen Beobachtungen verschiedener Autoren folgert, daß die Actin-vermittelte Zelladhäsion bei den Granuloreticulosea eine eher untergeordnete Rolle spielt. Während sie bei den Foraminiferen primär zu Verankerung und Transport des Gehäuses dient, ist bei der Athalamiden Reticulomyxa diese Funktion überflüssig, da sich das Zentralplasma durch Strömung innerhalb des RPN fortbewegen kann, ohne daß eine Schale mitgeführt werden müßte (Hülsmann, 1984). Die Verankerung des RPN selbst bringt hingegen eine größere Gefährdung durch das Abreißen von Zellteilen durch mechanische Beschädigungen mit sich, als der eher lose Bodenkontakt.
Cysten und Ruhestadien
Die Fähigkeit von Reticulomyxa filosa, unter ungünstigen Lebensbedingungen wie Kälte und Hunger Cysten hervorzubringen, ist schon von der Erstbeschreiberin (Nauss, 1949) entdeckt worden. Erst sehr viel später wurde in verschiedenen Laboratorien festgestellt, daß außer typischen Cysten auch hüllenlose Ruhestadien gebildet werden (Gothe, pers. Mitteilung).
Ruhestadien
Die Ruhestadien sind von der normalen Schleimhülle umgeben und besitzen keine besonderen Oberflächendifferenzierungen. Die Struktur des Plasmas unterscheidet sich nur wenig von der aktiver Zellen. Der einzige Unterschied ist das Auftreten zahlreicher dicht gepackter parakristalliner Tubulin-Aggregate, wie sie sonst nur in schwächerer Ausprägung in kältebehandelten Zellen gefunden werden. Der Stoffwechsel ist nicht wie bei Cysten eingeschränkt, was sich in der geringen Lebensdauer der Ruhestadien und der Bereitschaft zum schnellen Wiederaufbau eines RPN zeigt. Auch bei längerer Lagerung gehen Ruhestadien nicht in Cysten über.
Aus den vorangestellten Beobachtungen kann geschlossen werden, daß es sich bei den Ruhestadien um temporäre Erscheinungen begrenzter Lebensdauer handelt, ähnlich wie die stark retardierten Zellkörper in Folge von Kälteinkubationen.
Cysten
Gutirrez et al. (1990) entwickelten ein generelles Modell der Endocystierung an Ciliaten, das sich in dieser allgemeinen Form auch auf Reticulomyxa anwenden läßt. Die Stadien dieses Encystierungsmodells sind:
- Die Cystenbildung wird meist durch Hunger induziert.
- Spezielle Encystierungsgene werden angeschaltet.
- Es kommt zur Autophagie; die Abbauprodukte sind Ausgangsstoffe für die Synthese spezieller Cystenproteine.
- Das Plasma dehydriert.
- Der Verlust intrazellulären Wassers führt zu einem ametabolen Zustand.
- Die Cystenbildung schließt mit der Ausformung einer Cystenhülle ab.
Die Stadien des Modells nach Gutirrez et al. (1990) lassen sich mit wenigen Ausnahmen auch an Reticulomyxa verfolgen. Die Cystenbildung wird zumeist durch Hunger induziert, was sich auch daran zeigt, daß zumeist Zellen an der nährstoffärmeren Wasseroberfläche encystieren. Durch den Abbau von Zellorganellen, bis hin zur Autophagie von Zellkernen (Abb. 82) werden Bausteine und Energie für den Stoffwechsel gewonnen. Ein Großteil der Abbauprodukte wird anscheinend nicht exocytiert sondern verbleibt als Residualkörper im Zellplasma.
Durch den Vergleich von normalen Zellen und Cysten konnte festgestellt werden, daß die Tubulinkonzentration im Plasma nicht verringert wurde, obwohl keine MT oder HF mehr sichtbar sind. Ähnliches wurde von Nakamura und Matsusaka (1985) auch schon an Ciliaten beobachtet, die ebenfalls bei der Encystierung die abgebauten MT in einen Pool freien Tubulins überführen. Soweit das Vorkommen von Tubulin-Isotypen im Cysten untersucht wurde, zeigten sich keine Unterschiede zu den normalen Zellen.
Die Dehydrierung des Plasmas läßt sich im EM allein schon an dem geänderten Kontrastierungsverhalten der Präparate erahnen. Das Plasma wird deutlich elektronendichter, und insbesondere die zahlreichen Reservestoffgranula werden elektronendicht kontrastiert (Abb. 84).
Diese Veränderungen gehen mit der Bildung einer grob fibrillären Cystenhülle einher, die das Produkt eines massiven Exocytoseprozesses ist. Wahrscheinlich besteht die Hülle, wie auch bei Ciliaten (Martin-Gonzalez et al., 1991; Rios et al., 1992), aus Proteinen, denn in den Extrakten ausgebildeter Cysten (Abb. 93) finden sich eine ganze Reihe stark saurer Proteine mit einem Gewicht um 20 kD, die in aktiven Zellen nicht vorhanden sind. Die Cystenhülle ist im Gegensatz zu denen der meisten untersuchten Organismen (Ruthmann & Kuck, 1985; Lasman, 1982; Lasman, 1977) nicht in Exo- und Endocyst gegliedert. Sie weist aber (Abb. 84) einen deutlichen Gradienten von feinfibrillären Substanzen auf der Außenseite, hin zu gröberen Fibrillen auf der Innenseite auf. Da die Cyste nach außen hin noch von der Schleimhülle des Zellkörpers umgeben ist, ergibt sich auf diese Weise ebenfalls ein zweischichtiger Aufbau.
Wenn die Hüllenbildung abgeschlossen ist, sind die Cysten für viele Monate lagerfähig, bevor sie durch Medienwechsel wieder zum Auswachsen gebracht werden können. Das Auswachsen erfolgt nicht durch besondere präformierte Aperturen sondern anscheinend durch lokalen enzymatischen Abbau der Cystenwand.
Tubulin-Isotypen im Cytoskelett von Reticulomyxa
Die Tubuline, die Hauptproteine der Mikrotubuli, sind eine Proteinfamilie mit zahlreichen Mitgliedern. Die bekanntesten und mengenmäßig häufigsten Vertreter dieser Familie sind a- und b-Tubulin, die den Hauptbestandteil der MT darstellen. Ende der 80er Jahre wurde von Oakley und Oakley (1989) mit g-Tubulin ein weiteres Mitglied der Familie aufgefunden, das von Joshi et al. (1992) später in den Centrosomen lokalisiert wurde. Neuerdings wurden im Rahmen der Caenorhabditis- und Saccharomyces-Genprojekte weitere Gene gefunden, die aufgrund ähnlicher Gensequenzen zur Tubulinfamilie hinzugerechnet und als d- und e-Tubulin bezeichnet werden (Burns, 1995).
Tubuline sind hochkonservierte Proteine (Doolittle, 1995); vergleicht man a-Tubuline verschiedener Organismen miteinander, so erhält man typischerweise Sequenzhomologien zwischen 65 und 100% (Burns, 1995). Der Vergleich zwischen a- und b- oder g-Tubulinen zeigt immerhin noch zwischen 30 und 40% Sequenzhomologien (Burns, 1995). Dieses konservative Verhalten erklärt sich daraus, daß Mikrotubuli als zentrale Bestandteile der mitotischen Spindel unter besonderem evolutionären Druck stehen. Mutationen können fehlerhafte Mitosen mit fatalen Konsequenzen für die Zellen zu Folge haben.
Der Schritt zur Ausbildung eines Cytoskeletts aus Tubulin oder verwandten Proteinen scheint schon vor der Entwicklung der Eucyte vollzogen worden zu sein. Bei vielen Eu- und Archebakterien finden sich ebenfalls Mikrotubuli-ähnliche Strukturen, die diesen in vielen Eigenschaften, wie röhrenförmigem Aufbau aus Protofilamenten, teilweise sogar Reaktivität mit Anti-Tubulin Antikörpern, verwandt sind. Auf Proteinebene hat man in dem sogenannten FtsZ-Protein, das in vielen Prokaryoten vorkommt, einen möglichen Tubulin-Vorläufer gefunden (Review in Erickson, 1995).
In den meisten Organismen sind die verschiedenen Tubuline in mehreren unabhängigen Kopien im Genom vorhanden. Im menschlichen Genom sind mindestens 3 verschiedene a-Tubulin- und mindestens 4 verschiedene b-Tubulin-Isoformen nachgewiesen worden (Luduena, 1993), die außerdem auf verschiedene Weise posttranslationell modifiziert sein können.
Die Terminologie unterscheidet zur Zeit nicht scharf zwischen Tubulinen, die sich durch die Gensequenz unterscheiden und solchen, die sich durch posttranslationelle Modifikationen unterscheiden. Um diese beiden Vorgänge klar zu trennen, werden in dieser Arbeit die Produkte verschiedener Gene als Isoformen bezeichnet, während die durch posttranslationelle Vorgänge veränderten Tubuline Isotypen genannt werden.
Tubulin-Isoformen in Reticulomyxa filosa
Die Tubulin-Isoformen von Reticulomyxa wurden erst kürzlich von Linder et al. (1996) charakterisiert. Bei der Analyse des Genoms identifizierten sie zwei a- und zwei b-Tubulin-Gene. Die beiden a-Tubuline sind hochgradig homolog mit denen anderer Organismen, wohingegen die b-Tubuline ziemlich aberrant sind. Insbesondere das b2-Tubulin ist mit nur 53% Homologie stark abweichend. Das verwundert umso mehr, als b-Tubuline im allgemeinen konservativer sind, als a-Tubuline (Adoutte et al., 1996). Ähnlich stark abweichende b-Tubuline sind bislang nur von Entamoeba histolytica bekannt (Katiyar & Edlind, 1996). Das einzige b-Tubulin von Entamoeba hat eine Homologie von 54 bis 58% zu dem anderer Organismen.
Linder et al. (1996) konnten zwar die Tubulin-Gene von Reticulomyxa in pro- und eukaryotischen Systemen exprimieren, die synthetisierten Peptide erwiesen sich jedoch als nicht polymerisationsfähig und copolymerisieren auch nicht mit Hirntubulin.
Massenbestimmung und Verteilung in der Zelle
Folgende Angaben haben Linder et al. zu den Eigenschaften der gefundenen Tubulin-Isoformen bei Reticulomyxa gemacht:
| Tubulin-Isoform | Molekulargewicht
(kD) | Markierbarkeit durch Antikörper | |
|---|---|---|---|
| in der IIF | im Western Blot | ||
| a1 | 49,7 | ||
| a2 | 49,7 | TAT1 | TAT1 |
| b1 | 49,6 | WA3 | |
| b2 | 52,5 | Nr. 11 | Nr. 11 |
Tabelle 12: Angaben von Linder et al. zu den Eigenschaften von Reticulomyxa-Tubulinen.Die angegebenen Molekulargewichte sind aus der Gensequenz errechnet, stimmen aber nach Augenschein mit der Motilität exprimierter Tubuline in der Gelelektrophorese überein. Die Angaben zur Markierbarkeit durch Antikörper in der IIF beziehen sich auf Zellen von Reticulomyxa, die immer durchgehend markiert waren; die Angaben zur Markierbarkeit im Western Blot hingegen auf die künstlich exprimierten Proteine. (Linder, pers. Mitteilung.) |
|||
Die Ergebnisse der vorliegenden Arbeit stehen in teilweisem Widerspruch zu den in-vitro Resultaten von Linder et al. (1996). Mit Hilfe das Antikörpers TAT1 konnte die von Linder als a2-Tubulin bezeichnete Isoform eindeutig lokalisiert werden. Die Molekulargewichtsbestimmungen in SDS-PAGE und MALDI-TOF ergaben mit großer Übereinstimmung ein Gewicht von 51,8 kD.
Welche Ursache die Differenz von 2,1 kD zwischen errechnetem und gemessenem Wert hat, ist nicht erklärbar. Tubulin wandert in der Elektrophorese generell weniger weit, als es seinem Molekulargewicht entspräche (Dustin, 1984). So wurde von verschiedenen Autoren in der SDS-PAGE das MW von Hirntubulin mit 55 kD bestimmt; die Sequenzanalyse ergab jedoch ein Gewicht von nur 50 kD. Eine Abweichung nach oben kann also erwartet werden. Das Ergebnis der MALDI-TOF Massenspektroskopie hingegen sollte von solchen strukturspezifischen Eigenheiten nicht beeinflußbar sein. Das Spektrum, das zur Bestimmung der Masse des a2-Tubulins benutzt wurde (s. S. 57) weist allerdings ein sehr breites Maximum aus, so daß eine gewisse Fehlerbreite der Messung durchaus möglich wäre.
Gänzlich unerwartet fällt jedoch ein weiteres a-Tubulin auf, das mit zwei a-Tubulin-spezifischen Antikörpern markiert werden konnte. Dieses Tubulin hat eine Masse von nur 46,5 kD und korrespondiert mit keinem der von Linder nachgewiesenen Tubulin-Gene. Die Massendifferenz zu dem von Linder charakterisierten a1-Tubulin beträgt zwar nur 3,2 kD, aber in Richtung auf ein leichteres Protein. Selbst, wenn man einen systemimmanenten technischen Meßfehler annähme, der sowohl bei SDS-PAGE, als auch bei MALDI-TOF Massenspektroskopie aufträte, so sollte man doch annehmen, daß er bei zwei so ähnlichen Proteinen, wie den von Linder charakterisierten a1 und a2-Tubulinen, in die gleiche Richtung weisen müßte.
Wahrscheinlicher ist jedoch, daß die in dieser Arbeit vorgenommene Mittelung zwischen Molekulargewichtsbestimmung aus SDS-PAGE und MALDI-TOF-MS ein etwas verzerrtes Bild ergibt, da (wie oben erwähnt) die Gewichtsbestimmung in der SDS-PAGE bei Tubulin im allgemeinen zu hohe Werte ergibt. Diese Tendenz konnte auch in meinen Messungen bestätigt werden. Die Molekulargewichtsbestimmung in der SDS-PAGE lag immer zwischen 0,5 und 11 % über dem Ergebnis für das gleiche Protein im MALDI-TOF. Es ist also wahrscheinlich, daß dieses Tubulin leichter als der Mittelwert der Meßwerte ist.
Diese Differenz zwischen den Ergebnissen der Analysen von Genom und lebendem Organismus läßt die beiden folgenden Erklärungsansätze als die wahrscheinlichsten erscheinen: Entweder
- Reticulomyxa hat drei a-Tubulin Gene, und das außergewöhnlich leichte Tubulin entstammt diesem dritten Gen, oder:
- Es liegt eine außergewöhnliche Prozessierung der mRNA für a1 vor (oder eine ungewöhnliche posttranslationale Modifikation, die das Protein um ganze 3,1 kD - entspricht ca. 30 Aminosäuren - leichter macht). Zusätzliche, durch posttranslationelle Modifikationen (Phosphorylierungen) übertragene Ladungen würden zwar die Gewichtsbestimmung in der SDS-PAGE beeinträchtigen, könnten aber die Massenbestimmung im MALDI-TOF nicht beeinflussen.
Da es keine Kreuzreaktionen zwischen den Antikörpern gibt, die mit a2 oder dem leichten a-Tubulin reagieren, scheint eine direkte Beziehung zwischen den beiden Proteinspezies eher unwahrscheinlich. Da das leichte a-Tubulin, ebenso wie a2-Tubulin, in der IIF deutlich ein MT-typisches Verteilungsmuster im RPN von Reticulomyxa zeigt, ist auch die Annahme, es handelte sich eventuell gar nicht um Tubulin, sondern um ein anderes Protein mit ähnlichen Epitopen, ausgeschlossen.
Das in dieser Arbeit identifizierte b-Tubulin ist mit 55,5 kD 3 kD schwerer, als das b2-Tubulin von Reticulomyxa nach den Berechnungen von Linder et al. (1996) sein dürfte. Die Massendifferenz scheint aber auf dem schon mehrfach erwähnten Mißverhältnis zwischen MW und Laufstrecke für Tubulin in der SDS-PAGE zu beruhen. Die Massenbestimmung im MALDI-TOF ergab für dieses Protein 53 kD und liegt damit nur noch um 0,5 kD über dem berechneten Wert. Auch die Reaktion mit dem Antikörper Nr. 11 deutet darauf hin, daß es sich wirklich um das von Linder et al. (1996) beschriebene b2-Tubulin handelt.
Das b1-Tubulin von Reticulomyxa ließ sich mit den zur Verfügung stehenden Mitteln nicht nachweisen. Auch die kommerziellen Anti-b-Tubulin mAK ergaben keine positive Reaktion. Das schließt jedoch nicht aus, daß dieses Tubulin auch in-vivo transkribiert und in die MT eingebaut wird.
Bedeutung der außergewöhnlichen Tubulin-Isoformen für die Cytoskelettorganisation
Die Tubuline von Reticulomyxa weisen eine deutliche a/b-Inversion auf (d. h.: Das a-Tubulin ist deutlich leichter als das b-Tubulin), ein Symptom, das bisher vor allem bei Ciliaten, z.B. bei Euplotes und Oxytricha (Delgado et al., 1991) gefunden wurde.
Während die meisten Organismen mehrere Isoformen von a- und b-Tubulin besitzen, sind die MT innerhalb einer Zelle zumeist homogen. In Mehrzellern ist die Expression verschiedener Isoformen oft gewebeabhängig (Luduena, 1993). Cilien oder Flagellen tragende Protisten haben häufig nur je ein Gen für a- und b-Tubulin (Silflow, 1991), was mit einem höheren Selektionsdruck auf Mutanten erklärt wird (Gaertig et al., 1993). Sind in Protisten mehrere Gene vorhanden, sind die Isoformen oft gegeneinander austauschbar, wie bei Aspergillus (Schatz et al., 1986). Ähnlich verhält es sich auch in Physarum polycephalum. Dort werden je nach Entwicklungsstadium verschiedene Tubuline exprimiert, die einander jedoch vertreten können (Burland et al., 1993).
Es gibt nur sehr wenige Fälle, in denen eine spezielle Tubulin-Isoform essentiell notwendig ist, so z.B. das a-Tubulin tub67, das für die korrekte Funktion der Teilungsspindel in den Embryonen von Drosophila offensichtlich unersetzlich ist (Matthews et al., 1993). Das deutet darauf hin, daß die Eigenschaften der verschiedenen Isoformen in einem Organismus nicht zwingend identisch sind. Werden zum Beispiel in vitro MT hergestellt, die nur aus einzelnen Isoformen eines Organismus bestehen, so unterscheiden sich diese u.U. erheblich. Lu und Luduena (1994) stellten experimentell Heterodimere aus verschiedenen Isoformen der Säugetier-Tubuline her. In diesen Experimenten zeigte sich, daß MT aus den Tubulin-Untereinheiten a und bIV eine 10% höhere Polymerisationsrate haben, wie solche aus a und bIII. Die Heterodimere aus a und bIII haben eine viel längere lag-Phase bis zur Initiation der Polymerisation und erreichen auch nur ca. 70% der Polymerisationsrate von abIV. Daher schließen Panda et al. (1994), daß Zellen mit mehreren Isoformen über deren Häufigkeit die Dynamik der MT regeln.
Bei Reticulomyxa filosa kann man daher durchaus annehmen, daß die ungewöhnlichen Tubulin-Isoformen in Zusammenhang mit der ungewöhnlichen Dynamik der MT dieser Zelle stehen. Bei Entamoeba histolytica, dem einzigen Organismus, bei dem bislang ein ähnlich aberrantes b-Tubulin gefunden wurde, setzen Katiyar und Edlind (1996) diese Abweichungen mit den atypischen Eigenschaften des Cytoskeletts dieser Amöbe in Beziehung. Auch bei Reticulomyxa mag insbesondere das abnormale b-Tubulin eine große Rolle spielen, da auf diesem Tubulin die Vinblastin-Bindestelle liegt (Rai & Wolff, 1996). Eine Modifikation dieser Bindestelle steht womöglich im Zusammenhang mit der Fähigkeit, in vivo ohne Cytostatikagaben helikale Filamente zu bilden. In den Abweichungen von a- und b-Tubulinen zu denen anderer Zellen liegt mithin wahrscheinlich die Ursache für die Fähigkeit der Zelle, ihre MT nicht vollständig zu depolymerisieren, sondern in die Zwischenform der helikalen Filamente zu überführen. Wahrscheinlich sind auch andere Eigenarten des MT-Cytoskeletts auf solche Unterschiede zurückzuführen, so die relativ hohe Resistenz gegen Colchicin, Nocodazol und Kälte-induzierten MT-Abbau.
Ungeklärt bleibt dabei jedoch die Rolle der relativ normalen Tubuline. Mit a2 und b1 stehen der Zelle ja auch zwei Tubuline zur Verfügung, die denen anderer Organismen in Gensequenz und - wahrscheinlich - Funktion sehr viel ähnlicher sind. Während b1 nicht lokalisiert werden konnte und in vivo vielleicht nur in geringen Mengen transkribiert wird, weisen die Immunmarkierungen sowohl mit mAK TAT1, als auch mit dem mAK YOL 1/34, darauf hin, daß a2 in erheblichen Mengen vorhanden ist und in alle MT eingebaut wird.
Tubulin-Isotypen in Reticulomyxa filosa
In Unterscheidung zu den vorher behandelten Isoformen werden in dieser Arbeit als Isotypen diejenigen Proteine bezeichnet, die Produkt des gleichen Gens sind, aber unterschiedlich posttranslationell modifiziert worden sind.
Den ersten Hinweis auf die posttranslationelle Modifikation von Tubulin fanden Barra et al. (1973), die eine Inkorporation von radioaktiv markiertem Tyrosin in Rattenhirnextrakten auch dann beobachten konnten, wenn die reguläre Proteinsynthese inhibiert wurde. In der Zwischenzeit wurde eine Reihe anderer Modifikationen beschrieben: Acetylierung von Lysin 40 am a-Tubulin (z.B. Gaertig et al., 199)), Phosphorylierung des Tubulins durch die Insulin-Rezeptor Kinase (Wandosell et al., 1987), Polyglycylierung von a- und b-Tubulinen in einer Vielzahl von Organismen (Bressac et al., 1995; Levilliers et al., 1995), Polyglutamylierung von a- und b-Tubulinen in vielen Wirbeltieren (Fouquet et al., 1996; Ogata & Slepecky, 1995).
Die Untersuchungen zu den Tubulin-Isotypen an Reticulomyxa wurden zumeist mit Antikörpern durchgeführt, die ursprünglich gegen Vertebraten-Tubulin erzeugt wurden. Daher ist eine Fehlmarkierung oder Nichterkennung von Tubulinisotypen bei diesem Protisten nicht gänzlich auszuschließen. Durch die Verwendung von spezifischen mAKs gegen Protisten-Tubuline ließen sich einige Sachverhalte vielleicht eindeutiger klären.
Die Isotypen des leichten a-Tubulins: Das Glu/Tyr Paradoxon
An der posttranslationellen Tyrosinierung und Detyrosinierung des a-Tubulins sind zwei Enzyme beteiligt. Während die meisten a-Tubuline im Genom mit einem carboxyterminalen Tyrosin codiert sind (Greer & Rosenbaum, 1989) und auch so transkribiert werden, wird dieses terminale Tyrosin nach dem Einbau in MT relativ bald von dem Enzym Tubulin-Carboxypeptidase (TCP) abgespalten. Solange der MT besteht, bleibt dann das dem Tyrosin vorausgehende Glutamat am Carboxyterminus exponiert. Daher sind ältere MT im allgemeinen Glu-Tubulin reich (Wehland & Weber, 1987). Depolymerisieren MT, wird an das freie Tubulin von dem Enzym Tubulin-Tyrosin-Ligase (TTL) erneut ein Tyrosin angehängt (Beltramo et al., 1987), (Reviews in Greer & Rosenbaum, 1989; Barra et al., 1988; Bulinski & Gundersen, 1991).
Das Anfügen eines terminalen Tyrosins erfolgt im allgemeinen so schnell, daß nur 2% des löslichen Tubulins detyrosiniert sind (Bulinski & Gundersen, 1987). Dadurch sind neu entstehende MT immer ausschließlich aus Tyr-Tubulin aufgebaut, obwohl Glu-Tubulin prinzipiell genauso polymerisationsfähig ist (Raybin & Flavin, 1977). Die TCP hingegen braucht als Substrat MT und reagiert nicht mit gelöstem Tubulin (Arcre & Barra, 1985); freies Tubulin kann also nicht detyrosiniert werden.
In früheren Untersuchungen an Reticulomyxa (Lindenblatt, 1988; Hauser et al., 1989) wurde mit Hilfe des Anti-Glu-Tubulin mAK ID5 nachgewiesen, daß alle MT gleichmäßig Glu-Tubulin enthalten. Da außerdem der mAK YL 1/2, der spezifisch gegen Tyr-Tubulin konstruiert wurde (Kilmartin et al., 1982; Wehland et al., 1983; Wehland et al., 1984) und als verläßlich in der Tubulinmarkierung unabhängig von der Fixierung bekannt ist (Oka et al., 1994), kein Epitop in den MT von Reticulomyxa erkennt, wurde angenommen, daß alle MT dieses Organismus Glu-Tubulin reiche, stabile, physiologisch ältere MT seien.
Das stand in einem gewissen Gegensatz zu den Untersuchungen von Golz (1986), der in Allogromia vorwiegend mit dem mAK YL 1/2 markierbares Tyr-Tubulin beobachtete. Da beide Organismen über ein ähnliche funktionierendes MT-Cytoskelett verfügen, würde dies bedeuten, daß das Vorkommen von Glu- oder Tyr-Tubulin nicht essentiell für die Organisation des reticulopodialen Netzwerkes ist. Wenn MT, die in der Lage sind, in vivo in helikale Filamente und vice versa transformiert zu werden, in dem einen Organismus nur Glu-, in dem anderen nur Tyr-Tubulin enthalten, dann kann der Tyrosinierungs/Detyrosinierungsstatus dafür weder eine Vorbedingung noch ein Ausdruck dieser Eigenschaft sein.
Die Versuche, die der vorliegenden Arbeit zugrunde liegen, machen den Sachverhalt noch komplexer. Es zeigte sich im Western Blot, daß der Anti-Glu-Tubulin Antikörper ID5 die zwei Isotypen des außergewöhnlich leichten Tubulins markiert, und das eben diese Isotypen auch von dem Anti-Tyr-Tubulin mAK 27C2 erkannt werden. Würden die Antigene beider Antikörper Isotypen des gleichen Proteins sein, dann müßten sie sich zumindest geringfügig in Masse (das MW von Tyrosin beträgt ungefähr 180 D) und Ladung unterscheiden. Die Doppelmarkierung von 2D-Western Blots mit beiden Antikörpern zeigte jedoch, daß die Markierungen zwar unterschiedlich intensiv sind, aber an den gleichen Stellen der Blots liegen. Zudem bestätigten Doppelmarkierungen in der IIF, daß die beiden Antikörper sich gegenseitig in der Bindung behindern, was nahelegt, daß ihre Epitope eng benachbart sein müssen. Daraus resultiert die paradoxe Schlußfolgerung, daß die zwei Isotypen des leichten Reticulomyxa-Tubulins sich sowohl als Glu- als auch Tyr-Tubulin verhalten.
Da mit Hilfe der Antikörper 27C2 und ID5 demzufolge nicht definitiv entschieden werden kann, ob das leichte a-Tubulin von Reticulomyxa tyrosiniert oder detyrosiniert ist, wurde noch ein weiterer Anti-Tyr-Tubulin mAK eingesetzt, der die Bezeichnung 20C6 trägt. Dieser Antikörper reagiert jedoch in Western Blots überhaupt nicht mit dem leichten a-Tubulin, sondern scheint - sehr schwach - mit dem a2-Tubulin zu reagieren.
Eine Erklärung für die widersprüchliche Bindung der verwendeten Antikörper fällt schwer, denn alle verwendeten Antikörper sind monoklonal und gegen synthetische Peptide gerichtet und ihre hohe Spezifität wurde eingehend untersucht und bewiesen (Wehland & Weber, 1987). Sowohl 27C2 als auch 20C6 sind gegen ein Haemocyanin-gekoppeltes Octapeptid Gly-Glu-Glu-Glu-Gly-Glu-Glu-Tyr erzeugt worden. Dieses Octapeptid entspricht der Endsequenz von Vertebraten-a-Tubulin. Der mAK ID5 ist gegen ein identisches Peptid, dem das terminale Tyr fehlte und das an BSA gekoppelt wurde, erzeugt worden (Wehland & Weber, 1987).
Aus sehr eingehenden Untersuchungen mit dem Anti-Tyr-Tubulin mAK YL 1/2 (Wehland et al., 1984) weiß man, das auch solche hochspezifischen Antikörper in der Lage sind, Bindungen zu Aminosäuresequenzen einzugehen, die nicht mit dem ursprünglichen Antigen übereinstimmen. So ist der mAK YL 1/2 achtmal empfindlicher für das synthetische Peptid Gly-Glu-Glu-Glu-Gly-Glu-Glu-Phe, das ein terminales Phenylalanin trägt, als für das Octapeptid Gly-Glu-Glu-Glu-Gly-Glu-Glu-Tyr mit einem terminalem Tyrosin. Auf der anderen Seite sind auch die nicht direkt am C-Terminus exprimierten Aminosäuren relevant, denn die Bindung des YL 1/2 erfolgt an das Octapeptid Gly-Glu-Glu-Glu-Gly-Glu-Glu-Tyr ungefähr zehnmal so effektiv, wie an das Tripeptid Glu-Glu-Tyr.
Unter Berücksichtigung dieser Tatsachen lassen sich folgende Hypothesen für die Beschaffenheit des leichten a-Tubulins in Reticulomyxa aufstellen:
- Es handelt sich um Glu-Tubulin. Die Markierung mit dem Anti-Tyr-Tubulin mAK 27C2 erfolgte an ein unspezifisches Epitop. Die beiden Anti-Tyr-Tubulin mAK YL1/2 und 20C6 erkennen korrekt ihr Epitop nicht. Oder:
- Es handelt sich um Tyr-Tubulin mit einer außergewöhnlichen Endsequenz, die nur von dem Anti-Tyr-Tubulin mAK 27C2 erkannt wird. Der Anti-Glu-Tubulin mAK ID5 bindet nicht an ein carboxyterminales Glu, sondern an eine bei der Polyglutamylierung angehängte Seitenkette. (So erkennt der Anti-Glu-Tubulin mAK ID5 z.B. sämtliche Isoformen von Schweinehirntubulin, da diese ebenso wie die Tubuline vieler anderer Wirbeltiere (Ogata & Slepecky, 1995; Fouquet et al., 1996) posttranslationell glutamyliert werden.) Oder:
- Es handelt sich weder um Glu-, noch um Tyr-Tubulin, sondern um sogenanntes Delta-2-Tubulin (s.u.). Der Anti-Glu-Tubulin mAK ID5 bindet an polyglutamylierte Seitenketten. Der Anti-Tyr-Tubulin mAK 27C2 bindet an ein unspezifisches Epitop; die Anti-Tyr-Tubulin mAK 20C6 und YL 1/2 markieren korrekt nicht.
- Es handelt sich um polyglycyliertes Tubulin. Bei dieser Modifikation, die schon bei einem der evolutionär ältesten Eukaryoten, Giardia lamblia, auftritt, wird posttranslationell an den Carboxyterminus des a-Tubulins eine Kette von 2 bis 23 Glycylresten angehängt, die mit Ala-Tyr abgeschlossen wird (Weber et al., 1996). Es wäre möglich, daß Anti-Tyr-Tubulin mAK 27C2 fälschlich an die Endsequenz Ala-Tyr bindet. Die Markierung mit dem Anti-Glu-Tubulin mAK ID5 erfolgt möglicherweise an poly-Glu Seitenketten.
Welche der aufgestellten Hypothesen richtig ist, kann derzeit nicht aufgeklärt werden. Es konnte jedoch beobachtet werden, daß Cysten, die ja überhaupt kein polymeres Tubulin aufweisen, dennoch mit dem Anti-Tyr-Tubulin mAK ID5 stark reagieren. Wegen der hohen Aktivität der TTL ist das nichtpolymere Tubulin in anderen Zellen jedoch zumeist tyrosiniert (Bulinski & Gundersen, 1987), sofern ein Tyrosinierungs/Detyrosinierungszyklus vorliegt. Daher ist es sehr wahrscheinlich, daß das leichte a-Tubulin keinem derartigen Zyklus unterworfen ist, oder der mAK ID5 an ein anderes Antigen als das carboxyterminale Glutamin bindet.
In den letzten Jahren wurde in der Tat bei verschiedenen Organismen beobachtet, daß ihr a-Tubulin nur teilweise einem Tyrosinierungs/Detyrosinierungszyklus unterliegt. So wurde zum Beispiel von Arregui und Barra (1990) beobachtet, daß ein Großteil des a-Hirntubulins das mit einem Anti-Glu-Tubulin Antikörper markiert werden konnte, nicht tyrosinierbar ist. Paturle-Lafanechere et al. (1994) fanden später in einer ganzen Reihe von Zellen eine nicht-tyrosinierbare Variante des a-Tubulins, das Delta-2-Tubulin. Delta-2-Tubulin hat nicht nur das carboxyterminale Tyrosin, sondern auch das davor stehende Glutamat verloren und ist ein Kennzeichen hochstabiler MT-Strukturen, wie sie in Centrosomen und primären Cilien vorkommen. Nach Paturle-Lafanechere et al. (1994) taucht diese Isoform in taxolbehandelten Zellen auch in stabilisierten cytoplasmatischen MT auf, ebenso in Tubulin-Parakristallen nach Vinblastinbehandlung. Die Autoren vermuten, daß es sich um den Endzustand der Tubulin-Reifung in sehr alten Polymeren handelt.
Da die MT in Reticulomyxa wahrscheinlich nicht depolymerisiert, sondern zu HF abgebaut werden und vielleicht sogar wieder neu aus ihnen entstehen, sind die Tubuline wahrscheinliche Kandidaten für besonders gereifte Tubuline.
Wenn man als wahrscheinlichste Hypothese annimmt, daß das leichte a-Tubulin Delta-2-Tubulin darstellt, bleibt jedoch noch ungeklärt, was letztlich die beiden Isotypen des leichten Reticulomyxa-Tubulins voneinander unterscheidet. Da der mAK 6-IIB-1 gegen acetyliertes a-Tubulin weder in der IIF noch im WB mit Reticulomyxa-Tubulin reagiert, handelt es sich wahrscheinlich nicht um diesen Modifikationstyp. Es wäre möglich, daß beide a-Tubuline polyglutamyliert sind; in diesem Fall wäre es auch am wahrscheinlichsten, daß sie sich in der Anzahl der angehängten Glutamine (typischerweise zwischen 2 und 5 (Ogata & Slepecky, 1995)) unterscheiden. Im Fall der Hypothese d) würden sich die Effekte von Polyglutamylierung und Polyglycylierung überlagern und die beiden Isoformen erzeugen.
Die vier Isotypen des a2-Tubulins
Das normale a2-Tubulin von Reticulomyxa liegt in vier Isotypen vor, die sich im Gewicht kaum oder nicht unterscheiden, aber deutlich verschobene isoelektrische Punkte aufweisen. Alle Isotypen sind mit dem mAK TAT1 deutlich markierbar. Da der Antikörper YOL 1/34 in einem einzigen Fall auf einem 1-dimensionalen Western Blot ein Protein mit der Masse des a2-Tubulins markierte, ist anzunehmen, daß dieser Antikörper, der in der IIF besonders deutlich markiert, aufgrund einer ungünstigen Konformationsänderung dieses Tubulin nach der SDS-PAGE nicht mehr binden kann.
Auch der Anti-Tyr-Tubulin mAK 20C6 zeigt in der indirekten Immunfluoreszenz eine deutliche Reaktion, aber keine Bindung an geblottete Proteine. Da dieser mAK in Doppelmarkierungsversuchen mit dem mAK YOL 1/34 konkurriert, ist anzunehmen, daß er ebenfalls an a2-Tubulin bindet. Daher könnte es sich bei den gefundenen Isotypen des a2-Tubulins um Tyr-Tubulin handeln. Da das normale a2-Tubulin im Western Blot nicht mit dem eingesetzten Anti-Glu-Tubulin mAK ID5 reagiert, fehlt von diesem Tubulin jedoch anscheinend ein detyrosinierter Isotyp.
Ähnlich wie bei dem leichten a-Tubulin liegt diesmal wieder nur ein Isotyp des Tyrosinierungs/Detyrosinierungzyklus vor. Da die Beweise für ein ausschließlich tyrosiniertes a2-Tubulin jedoch wegen der fehlenden Immunreaktion auf Western Blots nur sehr indirekt sind, wird darauf hier nicht weiter eingegangen.
Für die Entstehung der vier Isotypen kann keine Polyglutamylierung verantwortlich sein, da der mAK ID5 in eigenen Versuchen diese Modifikation in anderen Tubulinen erkannt hatte, was auch von Wehland (persönliche Mitteilung) bestätigt wurde. Auch eine Acetylierung ist unwahrscheinlich, da der hierfür spezifische mAK 6-IIB-1 weder in der IIF noch im Western Blot an das Tubulin von Reticulomyxa band.
Als Erklärungsversuche blieben noch:
- Es handelt sich um vier Isoformen, die durch Polyglycylierung entstanden sind. Wegen der bei dieser posttranslationellen Modifikation angehängten Endsequenz Ala-Tyr (Weber et al., 1996) könnte eine Kreuzreaktion mit dem mAK 20C6 erklärt werden. Allerdings ist Polyglycylierung bisher nur an axonemalen Strukturen nachgewiesen worden (Weber et al., 1996; Levilliers et al., 1995), was ein Auftreten in Reticulomyxa unwahrscheinlich macht, da dieser Organismus keine derartigen Strukturen besitzt.
- Es handelt sich um verschiedene Phosphorylierungsstufen. Die elektrophoretische Mobilität ist abhängig vom Phosphorylierungsgrad des Tubulins (siehe Fig. 1C in (Wandosell et al., 1987)).
Die vier Isotypen des b2-Tubulins
Der Antikörper Nr. 11, der spezifisch gegen Reticulomyxa-b-Tubulin gerichtet ist, erkennt 2 Haupt- und zwei Nebentypen, die sich geringfügig im Molekulargewicht und deutlich im IEP unterscheiden. Dieses 2+2 Muster suggeriert, daß es sich um zwei unabhängige Modifikationen mit unterschiedlichen Häufigkeiten handele.
Da die Acetylierung von b-Tubulin m.E. bisher noch nicht beschrieben wurde und die Polyglutamylierung aus den bereits genannten Gründen unwahrscheinlich ist, geht die Entstehung dieser vier Isoformen am wahrscheinlichsten auf unterschiedliche Phosphorylierungs- und/oder Polyglycylierungsstufen zurück. Der geringe Unterschied in der Laufstrecke von den beiden Neben- im Vergleich zu den Haupttypen (vgl. Abb. 88f) legt nahe, daß die Haupttypen etwas schwerer sind. Das würde bedeuten, daß sich die Haupt- von den Nebentypen durch angehängte Aminosäuren - möglicherweise durch Polyglycylierung - unterscheiden, während sich die beiden Haupttypen (bzw. Nebentypen) untereinander durch eine andere Modifikation - z.B. Phosphorylierung - unterscheiden.
Die Phosphorylierung einzelner Isoformen des b-Tubulins ist eine bekannte und in in-vivo-Versuchen nachgewiesene Modifikation, die eine leichte Verschiebung des IEP in den sauren Bereich zur Folge hat (Gard & Kirschner, 1985). Bei Ihren Untersuchungen an Neuroblastoma-Zellen stellten Gard und Kirschner fest, daß die Differenzierung der Zellen und/oder die Behandlung mit Taxol zur Vermehrung phosphorylierter Tubulin-Isoformen führte. Die Phosphorylierung des b-Tubulins kann anscheinend nur an polymerisierten MT erfolgen.
Da das Tubulin von Reticulomyxa bekanntlich lange Zeit in polymerer Form existiert, wäre eine Phosphorylierung des b-Tubulins durchaus wahrscheinlich und damit eine mögliche Ursache für das Auftreten verschiedener Isoformen mit unterschiedlichen IEP.
Bedeutung der außergewöhnlichen Tubulin-Isotypen für die Cytoskelettorganisation
Es wurde in einer Reihe von Versuchen gezeigt, daß die Tubuline von Reticulomyxa nicht nur der Gensequenz nach, sondern auch in ihren posttranslationalen Modifikationen außergewöhnlich zu sein scheinen.
Die in der 2D-PAGE lokalisierten a-Tubuline reagieren zwar gelegentlich mit Glu- oder Tyr-Tubulin spezifischen Antikörpern, scheinen aber keinen Tyrosinierungs-/Detyrosinierungszyklus zu haben. Möglicherweise handelt es sich bei dem leichten a-Tubulin um Delta-2-Tubulin (Paturle-Lafanechere et al., 1994), die schließliche Reifungsform von a-Tubulin nach der Detyrosinierung.
Ebenso wie die Tyrosinierung / Detyrosinierung scheint dem Tubulin von Reticulomyxa in der Acetylierung ein weiteres Alterungszeichen (Greer & Rosenbaum, 1989) individueller MT zu fehlen. Den Tubulinen dieses Organismus fehlen also sowohl eindeutige Alters- als auch Jugendformen, stattdessen zeichnet es sich durch einen hohen Grad größtenteils nicht eindeutig identifizierter posttranslationaler Modifikationen aus. Das ist als eine Anpassung an die besondere Cytoskelettorganisation der Zelle zu sehen, die anscheinend die Depolymerisation zu freien Tubulin-Heterodimeren weitgehend ausschließt.
Die Transformation von MT in HF und vice versa ist eine besondere Anpassung des Organismus an seine Lebensweise, die den ständigen und rapiden Umbau des MT-Cytoskeletts erfordert. Durch die Bildung von helikalen Filamenten können MT schneller auf- und abgebaut werden. Zusätzlich bieten helikale Filamente den Vorteil, daß sie im Gegensatz zu Heterodimeren, die sich wahrscheinlich vorrangig durch Diffusion verteilen, aktiv durch die Zelle von Abbau- zu Aufbauorten transportiert werden können. Die Fähigkeit, helikale Tubulinfilamente einzusetzen, erforderte jedoch anscheinend von den Zellen massive Veränderungen der beteiligten Tubuline, sowohl in der Gensequenz, wie die Untersuchungen von Linder et al. (1996) deutlich machen, als auch durch mannigfaltige und außergewöhnliche posttranslationelle Modifikationen, wie im Rahmen der vorliegenden Arbeit gezeigt werden konnte.
